Содержание
Марганцево-цинковый элемент | это… Что такое Марганцево-цинковый элемент?
Марганцево-цинковый элемент.
(1) — металлической колпачок,
(2) — графитовый электрод («+»),
(3) — цинковый стакан («—»),
(4) — оксид марганца,
(5) — электролит,
(6) — металлический контакт.
Марганцево-цинковый элемент, также известный как элемент Лекланше — это первичный химический источник тока, в котором анодом является двуокись марганца MnO2 (пиролюзит) в смеси с графитом (около 9,5 %), электролитом — раствор хлорида аммония NH4Cl, катодом — металлический цинк Zn.
Является самым известным первичным элементом (батарея одноразового использования), который сегодня широко используется в переносных устройствах. Изначально элементы заполнялись жидким электролитом. В дальнейшем электролит стали загущать с помощью крахмалистых веществ — это позволяло сделать более практичные элементы питания, называемые сухими, в которых сведена к минимуму возможность вытекания электролита.
Содержание
|
История изобретения
Первый марганцево-цинковый элемент был собран Ж. Лекланше в 1865 г[1].
Характеристики
- Теоретическая энергоёмкость:
- Удельная энергоёмкость: 67-99 Вт•час/кг
- Удельная энергоплотность: 122—263 Вт•час/дм³.
- ЭДС: 1,51 В.
- Рабочая температура: −40 ÷ +55 °C.
Принцип действия
Процессы, происходящие в сухом элементе
При потреблении тока электроны поступают через внешнюю электрическую цепь с цинкового электрода на угольный стержень. Происходят следующие реакции:
Анод: Zn → Zn 2+ + 2e−
На угольном стержне электроны расходуются на восстановление H3O+-ионов:
Катод: 2H3O+ + 2e− → H2 + 2H2O
Ионы H3O+ образуются в результате частичного протолиза NH4+-ионов электролита:
NH4+ + H2O ↔ H3O+ + NH3
При восстановлении H3O+-ионов образуется водород, который не может удалиться (корпус герметичен) и образует вокруг угольного стержня прослойку газа (поляризация угольного электрода). Ток медленно затухает. Чтобы избежать образования водорода, угольный электрод окружают слоем диоксида марганца (MnO2) . В присутствии диоксида марганца H3O+-ионы восстанавливаются с образованием воды:
Ток медленно затухает. Чтобы избежать образования водорода, угольный электрод окружают слоем диоксида марганца (MnO2) . В присутствии диоксида марганца H3O+-ионы восстанавливаются с образованием воды:
2MnO2 + 2H3O+ + 2e− → 2MnO(OH) + 2H2O
Таким способом избегают поляризации электрода, а диоксид марганца называют деполяризатором. Электролит NH4Cl диссоциирует и частично протолизируется. В общем:
2NH4Cl + 2H2O ↔ 2NH3 + 2H3O+ + 2Cl−
Образующиеся на катоде ионы Zn2+ поступают в раствор и образуют труднорастворимую соль:
В общем:
Общая реакция: Zn + 2MnO2 + 2NH4Cl → 2MnO(OH) + [Zn(NH3)2]Cl2 Во время разрядки цинковый стакан растворяется. Во избежание вытекания электролита или продуктов реакции цинковый стакан имеет запас по толщине или окружён железной защитной оболочкой.
Во избежание вытекания электролита или продуктов реакции цинковый стакан имеет запас по толщине или окружён железной защитной оболочкой.
Устройство
Сухой элемент
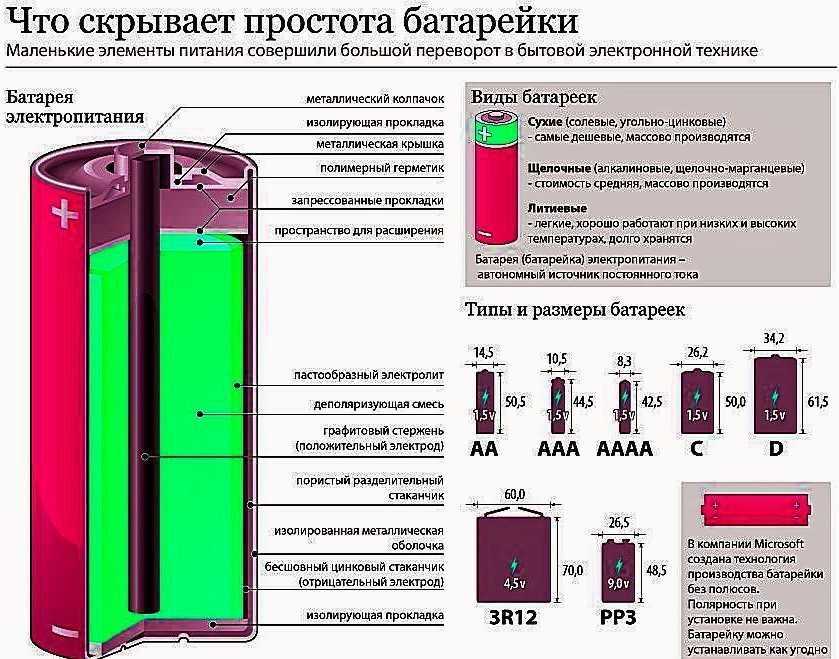
В качестве электродов в «сухом элементе» выступают цинковый стакан и угольный стержень. Поэтому сухой элемент называют еще угольно-цинковым элементом. Положительным электродом «+» является угольный стержень, отрицательным — цинковый стакан. Угольный стержень окружен смесью диоксида марганца MnO2 и угля (сажи). В качестве электролита выступает раствор хлорида аммония NH4Cl с небольшой добавкой хлорида цинка ZnCl2, загущенный крахмалом и мукой — это необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента. Тем не менее при неправильной эксплуатации или слишком длительном хранении электролит всё же может потечь или высохнуть.
Производство
Хранение и эксплуатация
Восстановление работоспособности
По мере разрядки цинковый стакан покрывается слоем цинкдиамминхлорида, за счёт чего увеличивается внутреннее сопротивление элемента. Частично восстановить ёмкость элемента можно, если удалить слой цинкдиамминхлорида с поверхности цинкового стакана. Сделать это удаётся несколькими способами:
Частично восстановить ёмкость элемента можно, если удалить слой цинкдиамминхлорида с поверхности цинкового стакана. Сделать это удаётся несколькими способами:
- путём деформации цинкового стакана
- подачей на выводы батареи переменного тока особой формы.
Второй способ нередко ошибочно называют перезарядкой. Стоит, однако, отметить, что оба способа сопряжены с риском повреждения цинкового стакана и подтекания электролита, а второй способ может также привести к взрыву элемента.
Другой распространённой причиной потери ёмкости является высыхание электролита. Это обычно происходит в тех случаях, когда элемент используется в течение длительного времени в устройствах, потребляющих небольшой ток (например, электронных часах), либо после длительного хранения. В этом случае восстановление работоспособности возможно после шприцевания батарейки водой, однако после необходимо плотно закрыть отверстие, иначе электролит может в скором времени снова высохнуть, либо начать подтекать.
Ещё одной известной неисправностью является коррозия (окисление) цинкового стакана. В результате окисления происходит истончение стакана, а также (при окислении контактных площадок) — увеличение сопротивления элемента. Коррозия в дальнейшем может также перекинуться на другие металлические детали, расположенные близко к батарее. Окислившийся элемент восстановлению не подлежит.
Области применения
Все первичные источники тока, за исключением серебряно-цинкового, обладают большим внутренним сопротивлением — десятки Ом, не допускающим разряда их токами большой силы из-за чрезмерного падения напряжения на внутреннем сопротивлении. Это надо помнить при использовании их в качестве силовых источников тока.
Примечания
- ↑ Марганцево-цинковый элемент // Большая советская энциклопедия.
Литература
- Кромптон. Т. Первичные источники тока. Москва. «Мир». 1986.г.
- ГОСТ 15596-82 Источники тока химические. Термины и определения
Ссылки
- Солевые и щелочные батарейки
- Батарея электропитания — Энциклопедия Кругосвет
Батарейки могут прожить несколько жизней
Как утверждают экологи, батарейки и аккумуляторы нельзя отправить на свалку, ведь в них содержатся тяжелые металлы и канцерогенные вещества, которые при разложении. ..
..
Автор: Александр Кубасов
Батарейки и
аккумуляторы используются в сотовых телефонах, бытовых приборах, часах. Со
временем источники питания вырабатывают свой ресурс, и встает вопрос, куда их
девать.
Как утверждают экологи, батарейки и аккумуляторы нельзя отправить на
свалку, ведь в них содержатся тяжелые металлы и канцерогенные вещества,
которые при разложении таят опасность для окружающей среды. Поэтому они
подлежат утилизации, к тому же вещества, извлекаемые из них
при переработке (графит, соли цинка и марганца), в дальнейшем
могут быть использованы как для создания новых элементов питания, так
и в других отраслях, в частности, в фармацевтике.
— Основу
щелочной батарейки, чаще используемой в бытовой жизни, составляет пиролюзит
(диоксид марганца). Природный пиролюзит — кристалл. В процессе работы батарейки
в химическую реакцию вступает лишь
внешняя поверхность кристалла. Когда на его поверхности образуется
корка, батарейка прекращает работать, хотя внутри еще достаточно марганца.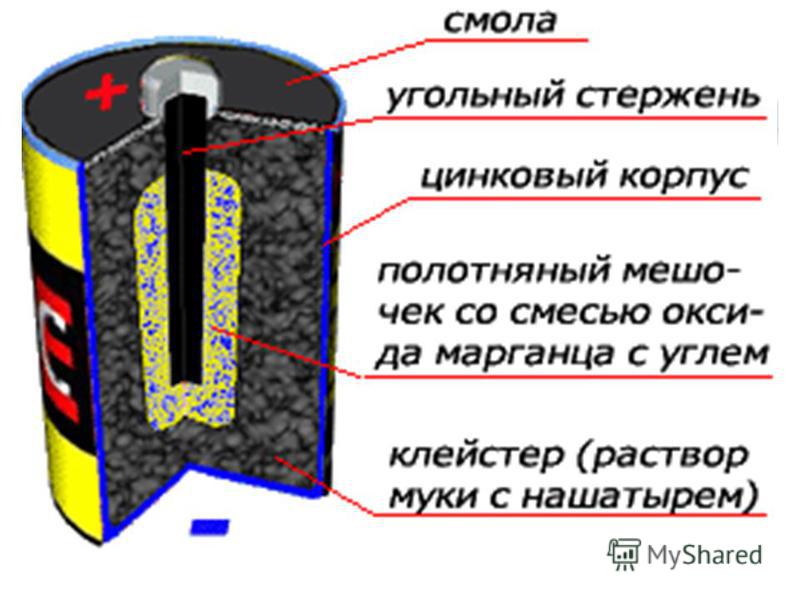 Чтобы
Чтобы
заставить пиролюзит выработать всю энергию, необходимо корку, образовавшуюся в
процессе работы, разрушить, а достичь этого возможно введением вовнутрь
батарейки хлорида ртути. В итоге батарейка «обретает вторую жизнь». Данный вид
небезопасный, поэтому ученые разработали синтетический пиролюзит, отличающийся
тем, что его структура напоминает «губку». За счет развитой поверхности диоксид
марганца полностью вырабатывает свой ресурс без добавления ртути, — разъясняет специалист по утилизации батареек и
аккумуляторов Владимир Мацюк.
— Батарейка, созданная на основе синтетического пиролюзита, безвредна для
окружающей среды. А цинк и марганец, содержащиеся в батарейке, плотно вшиты в
метаболизм человека. В частности оксид цинка добавляется в детские мази и
косметику.
| Батарейки и аккумуляторы подразделяются на несколько видов, отличающихся по составу: марганцево-цинковые (MnZn) — самые распространенные батарейки, чаще их называют щелочными и алкалиновыми; никель-металл-гидридные (NiMH) — используются в быту как альтернатива марганцево-цинковых батареек; литий-ионные (Li-ion) — используются в телефонах, камерах, ноутбуках; серебряно-цинковые (AgZn) — используются в часах и других миниатюрных электронных устройствах, а также в военной технике, ракетостроении и авиации; никель-кадмиевые (NiCd) — применяются для автономного питания некоторых моделей шуруповертов и дрелей, а также на электрокарах, самолетах и троллейбусах. |
Несмотря на то,
что марганец и цинк не способны убить даже ежа, мировым сообществом экологов
батарейки и аккумуляторы признаны опасным продуктом. С осени 2013 года в России
реализуется программа по сбору использованных источников питания и их
переработке. Первая в стране линия по извлечению металлов была запущена в
Челябинске. Однако технология предприятия позволяет перерабатывать только
щелочные и алкалиновые батарейки (марганцево-цинковые) гидрометаллургическим
способом на 80 процентов.
Сначала батарейки
сортируют вручную, затем их дробят в несколько этапов и при помощи
магнита отделяют железо. Из оставшейся полиметаллической смеси при помощи
гидрометаллургии выделяют соли, которые сперва растворяются, а потом
кристаллизуются. «На выходе» получают графит, сульфаты цинка и марганца.
Никель-металл-гидридные, литий-ионные и
никель-кадмиевые аккумуляторы служат
гораздо дольше, нежели щелочные и алкалиновые батарейки. Содержащийся в их
составе никель — наиболее опасный металл для окружающей среды, поэтому после
полной выработки аккумуляторы подлежат утилизации. В крупных торговых центрах и
В крупных торговых центрах и
гипермаркетах электроники Media Markt установлены специальные контейнеры для сбора
батареек и аккумуляторов.
Высокообратимая нейтральная цинково-марганцевая батарея для стационарных накопителей энергии
Цунсинь
Се, аб
Тяньюй
Ли, и
Цунчжи
Дэн, б
Ян
Песня, и
Хуамин
Чжан и
и
Сяньфэн
Ли
* и
Принадлежности автора
*
Соответствующие авторы
и
Отдел накопления энергии, Даляньская национальная лаборатория чистой энергии (DNL), Даляньский институт химической физики, Китайская академия наук, 457 Zhongshan Road, Далянь 116023, КНР
Электронная почта:
lixianfeng@dicp. ac.cn
ac.cn
б
Университет Китайской академии наук, Пекин 100039, КНР
Аннотация
Батареи на основе
марганца (Mn) привлекли значительное внимание благодаря своим привлекательным характеристикам низкой стоимости, изобилия земли и экологичности. Однако плохая стабильность положительного электрода из-за проблем с фазовым превращением и структурным разрушением препятствует их пригодности для перезаряжаемых батарей. Здесь мы представили высокообратимую и стабильную реакцию твердого тела с двухэлектронным переносом на основе MnO 2 и растворимый Mn(CH 3 COO) 2 (Mn(Ac) 2 ) в нейтральной среде. Благодаря координирующему эффекту Ac − , Mn 2+ может непосредственно осаждаться на электроде в форме MnO 2 , который полностью отличается от других солей марганца (Mn6 7 7 9004 ). 4 или MnCl 2 ). По сравнению с катодом с обычным механизмом интеркаляции, реакция растворения/осаждения полностью исключает проблему коллапса структуры, что приводит к значительному улучшению стабильности. Кроме того, в отличие от окислительно-восстановительной пары Mn 3+ /Mn 2+ можно полностью избежать внутренних проблем, вызванных непропорциональностью Mn 3+ . Подтверждением концепции может служить нейтральная проточная Zn-Mn батарея с оптимизированным электролитом. MnO 2 может идеально осаждаться на графитовом волокне с удельной емкостью 20 мА ч см -2 , что является самым высоким значением, о котором когда-либо сообщалось.
Благодаря координирующему эффекту Ac − , Mn 2+ может непосредственно осаждаться на электроде в форме MnO 2 , который полностью отличается от других солей марганца (Mn6 7 7 9004 ). 4 или MnCl 2 ). По сравнению с катодом с обычным механизмом интеркаляции, реакция растворения/осаждения полностью исключает проблему коллапса структуры, что приводит к значительному улучшению стабильности. Кроме того, в отличие от окислительно-восстановительной пары Mn 3+ /Mn 2+ можно полностью избежать внутренних проблем, вызванных непропорциональностью Mn 3+ . Подтверждением концепции может служить нейтральная проточная Zn-Mn батарея с оптимизированным электролитом. MnO 2 может идеально осаждаться на графитовом волокне с удельной емкостью 20 мА ч см -2 , что является самым высоким значением, о котором когда-либо сообщалось.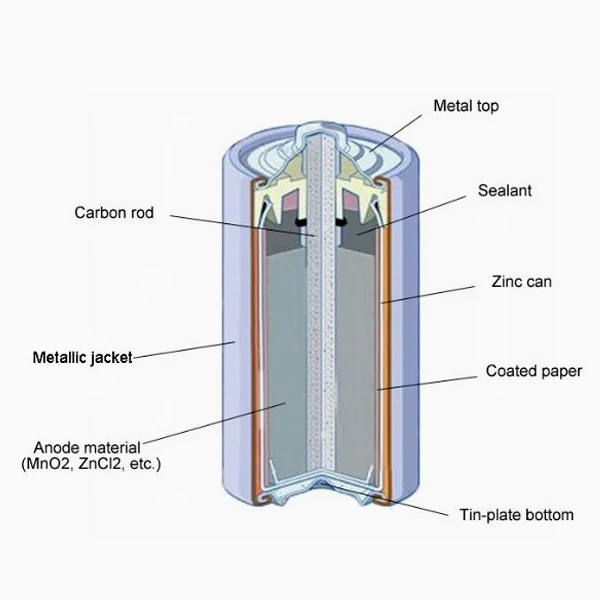 В отличие от щелочных электролитов, система с нейтральным потоком может эффективно избежать проблем с дендритами цинка. В результате проточная Zn-Mn батарея продемонстрировала КЭ 99% и EE 78% при 40 мА см -2 с более чем 400 циклами. В сочетании с превосходной электрохимической обратимостью, низкой стоимостью и свойствами переноса двух электронов батарея Zn-Mn может быть очень многообещающим кандидатом для крупномасштабного хранения энергии.
В отличие от щелочных электролитов, система с нейтральным потоком может эффективно избежать проблем с дендритами цинка. В результате проточная Zn-Mn батарея продемонстрировала КЭ 99% и EE 78% при 40 мА см -2 с более чем 400 циклами. В сочетании с превосходной электрохимической обратимостью, низкой стоимостью и свойствами переноса двух электронов батарея Zn-Mn может быть очень многообещающим кандидатом для крупномасштабного хранения энергии.
- Эта статья является частью тематического сборника:
Аккумуляторная наука и технология – на основе химии
Усовершенствованные батареи на основе оксида цинка и марганца. (Конференция)
Усовершенствованные батареи на основе оксида цинка и марганца. (Конференция) | ОСТИ.GOV
перейти к основному содержанию
- Полная запись
- Другие родственные исследования
Аннотация не предоставлена.
- Авторов:
Дуай, Джонатон;
Ламберт, Тимоти Н .;
Келли, Мария
- Дата публикации:
- Исследовательская организация:
- Национальная лаборатория Сандия. (SNL-NM), Альбукерке, Нью-Мексико (США)
- Организация-спонсор:
- Управление электроэнергетики Министерства энергетики США (OE), Advanced Grid Research & Development. Инженерные исследования в области энергетических систем
- Идентификатор ОСТИ:
- 1527268
- Номер(а) отчета:
- ПЕСОК2018-6350D
664420
- Номер контракта с Министерством энергетики:
- АК04-94АЛ85000
- Тип ресурса:
- Конференция
- Связь с ресурсами:
- : предложено для презентации на Совещании по достижениям EFRC-NEES, которое состоялось 23–24 мая 2018 г.
 в Альбукерке, штат Нью-Мексико.
в Альбукерке, штат Нью-Мексико.
Конференция
- Страна публикации:
- США
- Язык:
- Английский
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Дуэй, Джонатон, Ламберт, Тимоти Н. и Келли, Мария. Усовершенствованные батареи на основе оксида цинка и марганца. . США: Н. П., 2018.
Веб.
Копировать в буфер обмена
Дуэй, Джонатон, Ламберт, Тимоти Н. и Келли, Мария. Усовершенствованные батареи на основе оксида цинка и марганца. . Соединенные Штаты.
Копировать в буфер обмена
Дуэй, Джонатон, Ламберт, Тимоти Н. и Келли, Мария. 2018.
и Келли, Мария. 2018.
«Усовершенствованные батареи на основе оксида цинка и марганца». Соединенные Штаты. https://www.osti.gov/servlets/purl/1527268.
Копировать в буфер обмена
@статья{osti_1527268,
title = {Усовершенствованные батареи на основе оксида цинка и марганца.},
автор = {Дуэй, Джонатон и Ламберт, Тимоти Н. и Келли, Мария},
abstractNote = {Аннотация не предоставлена.},
дои = {},
URL = {https://www.osti.gov/biblio/1527268},
журнал = {},
номер =,
объем = ,
место = {США},
год = {2018},
месяц = {6}
}
Копировать в буфер обмена
Просмотр конференции (4,10 МБ)
Дополнительную информацию о получении полнотекстового документа см. в разделе «Доступность документа».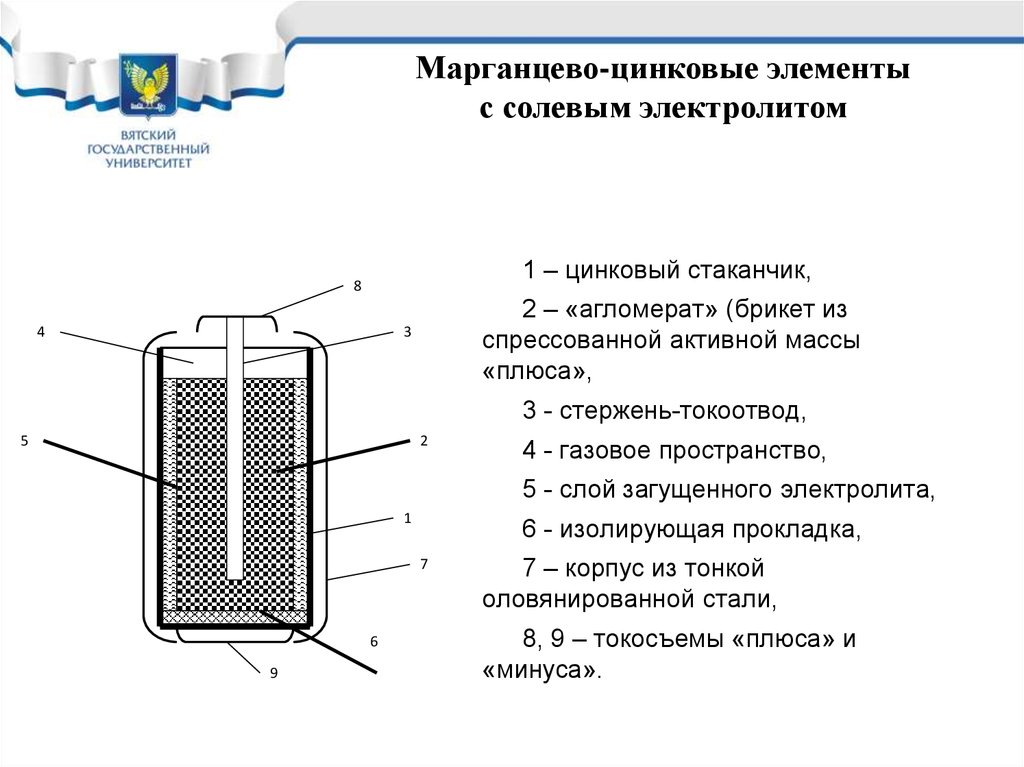

 в Альбукерке, штат Нью-Мексико.
в Альбукерке, штат Нью-Мексико.