Содержание
Franke MOL 651-E — Основа Кухни
| Тип мойки | Врезная | Материал | Нержавеющая сталь |
| Размер чаши | 402x383x150/191x250x80мм | Бренд | Franke |
| Внешние размеры | 960х500мм | Комплектация | сифон, вентиль 3,5″ |
| Производитель | Franke | Гарантия | 10 лет |
| Крыло | Слева | Отверстие под смеситель | Нет (вырезается при установке) |
| Страна-производитель | Германия | База | 900мм |
| Количество чаш | Большая + дополнительная | Длина мойки | 960мм |
| Ширина мойки | 500мм | Глубина чаши | 150мм |
| Перелив | Отсутствует |
Мойки Franke производятся из нержавеющей стали самого высокого качества марки AISI 304. Такая сталь содержит 18% хрома и 10% никеля, а значит она будет служить десятилетиями, не поддаваясь ржавчине и старению.
Такая сталь содержит 18% хрома и 10% никеля, а значит она будет служить десятилетиями, не поддаваясь ржавчине и старению.
Нержавеющая сталь – универсальный материал, который идеально сочетается с любым стилем и цветом кухни. Этот материал уникально сочетает в себе полный комплекс характеристик, необходимых на кухне:
- Стойкость к коррозии: при взаимодействии с кислородом воздуха на поверхности стали образуется пассивный самовосстанавливаемый защитный слой.
- Жаропрочность: сталь плавится при 1450 градусов и ей не страшны перепады температур. Горячие сковороды и кастрюли не оставляют на ней никаких следов.
- Эластичность: сталь тянется более чем на 50%, что позволяет производить мойки различной формы.
- Гигиеничность: поверхность абсолютно гладкая и не имеет пор. На ней не образуются бактериальные загрязнения, и она легко моется.
- Долговечность: износостойкость нержавеющей стали не превосходит никакой другой материал.
Стильная угловая кухонная раковина Franke MOL 651-Е из высокопрочной стали с рельефным декоративным покрытием. Модель с закругленными краями состоит из основной и дополнительной чаш, а также удобным крылом. Мойка для углового монтажа привнесет в интерьер изюминку, а ее функционал обеспечит долговечную и надежную службу.
Модель с закругленными краями состоит из основной и дополнительной чаш, а также удобным крылом. Мойка для углового монтажа привнесет в интерьер изюминку, а ее функционал обеспечит долговечную и надежную службу.
Размер: 960х500мм.
Размер чаши: 402x383x150/191x250x80мм.
Отзывы о товаре
К данному товару еще никто не оставлял отзывы. Вы можете
!
Оставить отзыв
Внимание! Отзывы от незарегистрированных пользователей публикуются только после предварительной проверки.
Если Вы не хотите ждать, пока отзыв появится на сайте, предлагаем Вам
Пароль
Запомнить меня
Регистрация
Забыли логин?
Забыли пароль?
MOL
MOL Group – интегрированная независимая международная нефтегазовая компания со штаб-квартирой в Будапеште, Венгрия. Она работает в более чем 40 странах с динамичным международным персоналом, насчитывающим 27 000 сотрудников, и имеет стаж работы в отрасли более 100 лет. Исследования компании MOL и ее производственная деятельность опираются на более чем 75-летний опыт работы с углеводородами. В настоящее время производственная деятельность ведется в 8 странах мира и исследовательская деятельность – в 14 странах. В MOL Group работают четыре нефтеперерабатывающих и два нефтехимических завода с объединенным управлением цепочкой поставок – в Венгрии, Словакии и Хорватии. Группа также имеет сеть, включающую в себя почти 2 000 станций технического обслуживания в 11 странах Центральной и Юго-Восточной Европы.
Исследования компании MOL и ее производственная деятельность опираются на более чем 75-летний опыт работы с углеводородами. В настоящее время производственная деятельность ведется в 8 странах мира и исследовательская деятельность – в 14 странах. В MOL Group работают четыре нефтеперерабатывающих и два нефтехимических завода с объединенным управлением цепочкой поставок – в Венгрии, Словакии и Хорватии. Группа также имеет сеть, включающую в себя почти 2 000 станций технического обслуживания в 11 странах Центральной и Юго-Восточной Европы.
История венгерской нефтяной промышленности началась в 1883 г. с создания Венгерской Нефтяной компании, которая осуществляла переработку добываемой нефти на заводе в г. Фиум (ныне Рийека, Хорватия). Это стал один из самых бурных периодов развития нефтяной отрасли: около 13 нефтеперерабатывающих заводов было построено в последующие 30 лет, что было связано с индустриальным подъемом региона и общим технологическим развитием Европы.
После ряда слияний, реструктуризаций, в 1991 году была образована компания MOL (MOL – аббревиатура Magyar Olaj és Gázipari Részvénytársaság, что означает Венгерская Нефтяная и Газовая компания), которая объединила под своим управлением всю венгерскую нефтяную отрасль, т. е. добычу и транспортировку нефти и газа, переработку нефти, производство топлива и смазочных материалов. Компания MOL является одной из наиболее прибыльных вертикально-интегрированных энергетических компаний в Европе, которая осуществляет добычу и транспортировку нефти и газа, занимается переработкой нефтепродуктов на собственных 5 (пяти) нефтеперерабатывающих заводах в Восточной и Центральной Европе. Владеет более чем 1500 автозаправочными станциями (Австрия, Венгрия, Германия, Италия, Румыния, Сербия, Хорватия, Словакия, Словения, Венгрия и Чехия).
е. добычу и транспортировку нефти и газа, переработку нефти, производство топлива и смазочных материалов. Компания MOL является одной из наиболее прибыльных вертикально-интегрированных энергетических компаний в Европе, которая осуществляет добычу и транспортировку нефти и газа, занимается переработкой нефтепродуктов на собственных 5 (пяти) нефтеперерабатывающих заводах в Восточной и Центральной Европе. Владеет более чем 1500 автозаправочными станциями (Австрия, Венгрия, Германия, Италия, Румыния, Сербия, Хорватия, Словакия, Словения, Венгрия и Чехия).
Одно из подразделений компании – MOL-LUB Ltd. – осуществляет разработку и производство смазочных материалов для всех отраслей европейской промышленности.
Имея более чем 100 летний опыт в разработке смазочных материалов (собственное производство базовых масел группы I, II, II+, III, IV, присадок и компонентов), компания занимает лидирующие позиции на европейском рынке успешно конкурируя по цене и качеству с другими ведущими компаниями-производителями масел.
Смазочные материалы MOL отвечают основным международным стандартам и спецификациям API, ACEA и имеют официальные допуски от производителей основных двигателей и автотехники, таких как Mercedes-Benz, Renault, Volvo, MAN , Scania, Cummins, DDC и др.
Ассортимент производимой MOL-LUB Ltd. продукции состоит из более чем 600 наименований, и ежегодно пополняется новыми маслами и смазками, соответствующими современным международным стандартам.
Перейти в каталог:
- CM MOL
e-moll — Викисловарь
Определение из Викисловаря, бесплатного словаря
Перейти к навигацииПерейти к поиску
Содержание
- 1 Венгерский
- 1.1 Этимология
- 1.2 Произношение
- 1.3 Существительное
- 1.3.1 Склонение
Венгерский [править]
Этимология
Произношение[править]
- IPA (ключ) : [ˈeːmolː]
- Дефис: ми минор
Существительное[править]
ми минор
- (музыка) ми минор
Склонение

притяжательный — единственное число
притяжательное — множественное число
| Притяжательные формы ми минор | ||
|---|---|---|
| владелец | одиночное владение | множественное владение |
| 1-е лицо поет. | э-моллом | электронный моллжаим |
| 2-е лицо поет. | э-моллод | электронный молджаид |
| 3-е лицо поет. | электронная молля | электронный моллджай |
| 1-е лицо множественного числа | электронный моллюск | электронная молния |
| 2-е лицо множественного числа | е-моллоток | е-моллджейток |
| 3-е лицо множественного числа | е-моллюк | электронный моллжаик |
Энергия активации
Энергия активации
Энергия активации
Прежде чем перейти к Энергии Активации, давайте еще раз взглянем на Законы Интегральной Скорости. В частности, использование реакций первого порядка для расчета периодов полураспада.
В частности, использование реакций первого порядка для расчета периодов полураспада.
Давайте рассмотрим, прежде чем продолжить…
Интегрированные формы тарифных законов:
Чтобы понять, как концентрации веществ в химической реакции изменяются со временем, необходимо интегрировать закон скорости (который дается как производная по времени от одной из концентраций), чтобы выяснить, как концентрации изменяются во времени. .
1. Реакции первого порядка
Предположим, у нас есть реакция первого порядка вида B + . . . . → продукты. Мы можем записать выражение скорости как rate = -d[B]/dt и закон скорости как rate = k[B] b . Приравняйте их друг к другу и проинтегрируйте следующим образом:
Закон скорости первого порядка является очень важным законом скорости, радиоактивный распад и многие химические реакции следуют этому закону скорости, и часть языка кинетики исходит из этого закона. Последнее уравнение в приведенной выше последовательности называется «экспоненциальным затуханием». Эта форма встречается во многих местах в природе. Одним из его следствий является то, что он порождает понятие, называемое «периодом полураспада».
Последнее уравнение в приведенной выше последовательности называется «экспоненциальным затуханием». Эта форма встречается во многих местах в природе. Одним из его следствий является то, что он порождает понятие, называемое «периодом полураспада».
Период полураспада
Период полураспада, обычно обозначаемый t 1/2 , представляет собой время, необходимое для того, чтобы [B] уменьшилось от своего начального значения [B] 0 до [B] 0 /2. Например, если начальная концентрация реагента А составляет 0,100 моль л -1 , период полураспада представляет собой время, при котором [А] = 0,0500 моль л -1 . В общем, используя интегрированную форму закона скорости первого порядка, мы находим, что:
Логарифмирование обеих частей дает:
Период полураспада реакции зависит от порядка реакции.
Реакция первого порядка : Для реакции первого порядка период полураспада зависит только от константы скорости:
Таким образом, период полураспада реакции первого порядка остается постоянным на протяжении всей реакции, даже если концентрация реагента уменьшается.
Реакция второго порядка : Для реакции второго порядка (в форме: скорость = k[A] 2 ) период полураспада зависит от обратной начальной концентрации реагента A:
Поскольку концентрация А снижается на протяжении всей реакции, период полувыведения увеличивается по мере развития реакции. То есть для снижения концентрации с 1 М до 0,5 М требуется меньше времени, чем для падения с 0,5 М до 0,25 М.
Вот график двух версий периода полураспада, показывающий, чем они отличаются (из http://www.brynmawr.edu/Acads/Chem/Chem104lc/halflife.html)
Давайте попробуем решить простую задачу: реакция первого порядка имеет константу скорости 1,00 с -1 . Каков период полураспада реакции?
Поскольку реакция первого порядка, нам нужно использовать уравнение: t 1/2 = ln2/k
t 1/2 = ln2/(1,00 с -1 ) = 0,6931 с
Теперь давайте попробуем решить более сложную задачу:
Период полураспада N 2 O 5 в разложении первого порядка при 25°C составляет 4,03×10 4 с.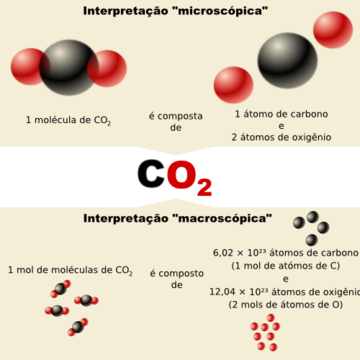 Что такое постоянная скорость? Какой процент N 2 O 5 останется через сутки?
Что такое постоянная скорость? Какой процент N 2 O 5 останется через сутки?
В сутках 24 часа * 60 мин/час * 60 сек/мин = 8,64×10 4 с
Таким образом, после окончания дня остается 22,6 %.
СЕЙЧАС, энергия активации:
Энергия активации (E a ) — это уровень энергии, который должны преодолеть молекулы реагентов, прежде чем может произойти реакция.
Вы, наверное, помните из CHM1045 эндотермические и экзотермические реакции:
Для расчета энергии активации нам необходимо уравнение, связывающее константу скорости реакции с температурой (энергией) системы. Это уравнение называется уравнением Аррениуса:
Где Z (или A в наше время) — константа, связанная с необходимой геометрией, k — константа скорости, R — газовая постоянная (8,314 Дж/моль-K), T — температура в градусах Кельвина.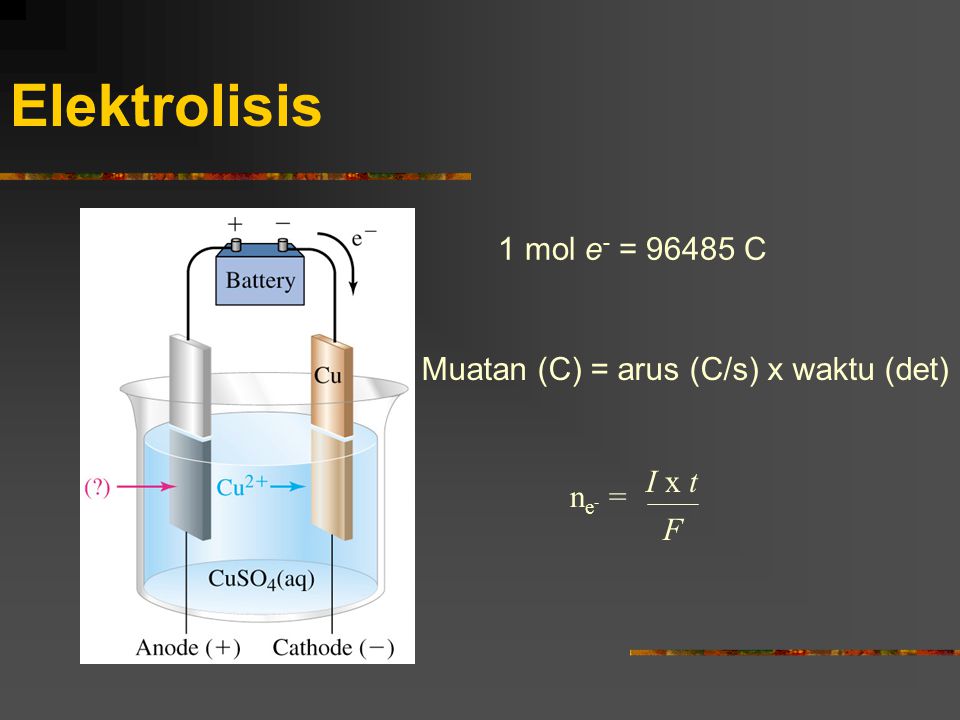 Если мы перестроим и возьмем натуральный логарифм этого уравнения, мы можем представить его в «прямолинейном» формате:
Если мы перестроим и возьмем натуральный логарифм этого уравнения, мы можем представить его в «прямолинейном» формате:
Итак, теперь мы можем использовать его для расчета энергии активации, построив график зависимости lnk от 1/T.
Когда lnk (константа скорости) изображается в зависимости от обратной величины температуры (в градусах Кельвина), наклон представляет собой прямую линию. Значение наклона (м) равно -Ea/R, где R — константа, равная 8,314 Дж/моль-К.
«Двухточечная форма» уравнения Аррениуса
Энергия активации также может быть найдена алгебраически путем подстановки двух констант скорости (k 1 , k 2 ) и две соответствующие температуры реакции (T 1 , T 2 ) в уравнение Аррениуса (2) .
Вычитание уравнения (4) из уравнения (3) дает
Преобразование уравнения (5) и решение для E a дает
Давайте попробуем решить задачу:
Константа скорости реакции H 2 (г) + I 2 (г) —> 2HI(г) равна 5,4 x 10 -4 M -1 с -1 при 3 26 или К.
При 410 o C константа скорости оказалась равной 2,8 x 10 -2 M -1 с -1 .
Рассчитать a) энергия активации и b) константа скорости ограничения высокой температуры для этой реакции.
Ответ:
Все реакции являются активированными процессами. Константа скорости экспоненциально зависит от температуры
Нам известна константа скорости реакции при двух разных температурах, и, таким образом, мы можем рассчитать энергию активации из приведенного выше соотношения. Во-первых, и всегда переводите все температуры в Кельвины, абсолютных 9.0050 температурная шкала. Затем просто найдите E a в единицах R.
.
ln(5,4 x 10 -4 M -1 с -1 / 2,8 x 10 -2 M -1 с -1 ) = (-E a /R){ 1/599 К — 1/683 К}
-3,9484 = — E a /R {2,053 x 10 -4 K -1 }
E a = (1,923 x 10 4 К) (8,314 Дж/К моль)
E a = 1,60 x 10 5 Дж/моль
Теперь, когда мы знаем E a , предэкспоненциальный множитель A (который является наибольшей константой скорости, которую может иметь реакция) может быть оценен из любой меры абсолютной константы скорости реакции.
так
5,4 х 10 -4 М -1 с -1 =
A exp{-(1,60 x 10 5 Дж/моль)/((8,314 Дж/К моль)(599K))}
(5,4 x 10 -4 M -1 с -1 ) / (1,141 x 10 -14 ) = 4,73 x 10 10 M 9004 0 -1 с -1
Константа скорости бесконечной температуры равна 4,73 x 10 10 M -1 с -1
Попробуйте один с графикой:
Изменение константы скорости реакции первого порядка с температурой для реакции первого порядка следующую таблицу. Определить графически энергию активации реакции.
| Т (К) | к (с -1 ) |
|---|---|
| 298 | 1,74 x 10 -5 |
| 308 | 6,61 x 10 -5 |
| 318 | 2,51 x 10 -4 |
| 328 | 7,59 x 10 -4 |
| 338 | 2,40 x 10 -3 |
Ответ:
График данных в lnk и 1/T.
