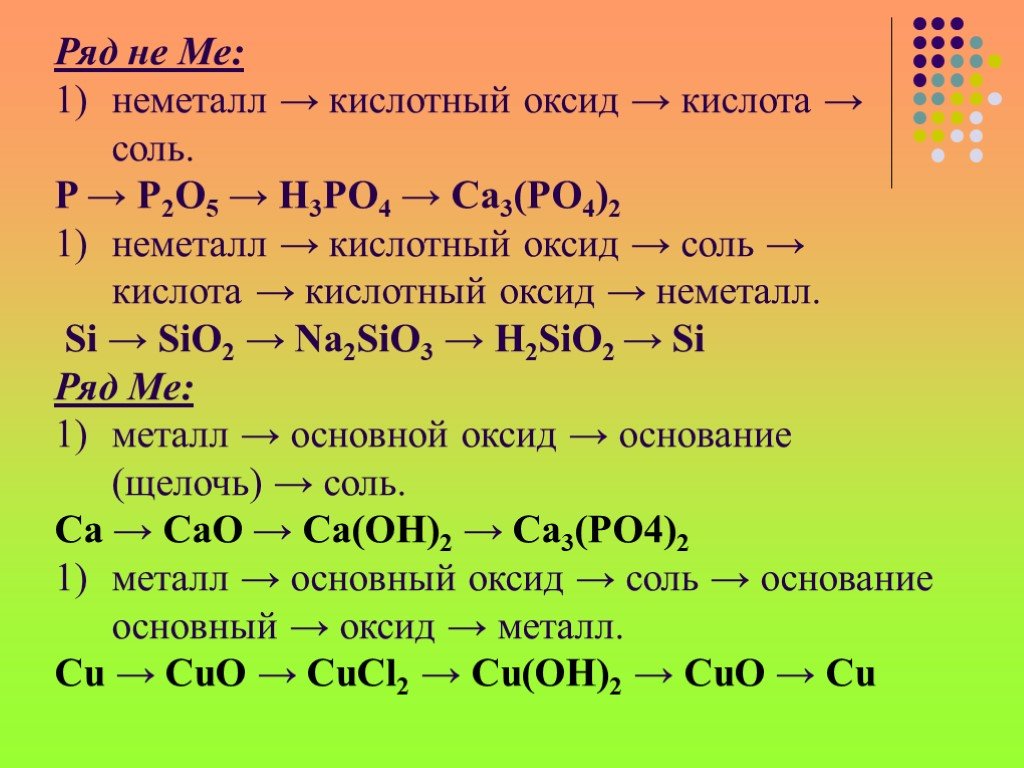
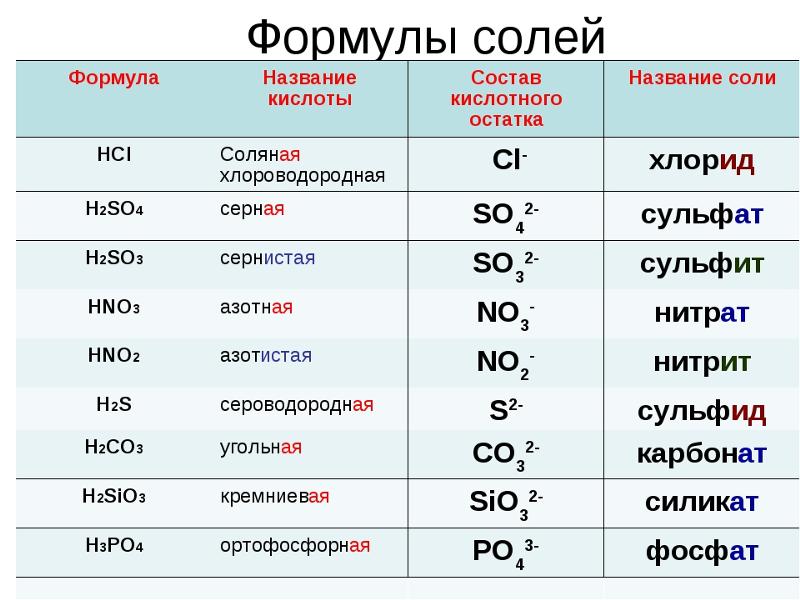
Содержание
Бродский А. И. Химия изотопов. — 1957 — Электронная библиотека «История Росатома»
Главная → Указатель произведений
ЭлектроннаябиблиотекаИстория Росатома
Ничего не найдено.
Загрузка результатов…
Закладки
Обложка123456789101112131415161718192021222324252627282930313233343536373839404142434445464748495051525354555657585960616263646566676869707172737475767778798081828384858687888990919293949596979899100101102103104105106107108109110111112113114115116117118119120121122123124125126127128129130131132133134135136137138139140141142143144145146147148149150151152153154155156157158159160161162163164165166167168169170171172173174175176177178179180181182183184185186187188189190191192193194195196197198199200201202203204205206207208209210211212213214215216217218219220221222223224225226227228229230231232232 вкл. 1232 вкл. 2233234235236237238239240241242243244245246247248249250251252252 вкл. 1253254255256257258259260261262263264265266267268269270271272273274275276277278279280281282283284285286287288289290291292293294295296297298299300301302303304305306307308309310311312313314315316317318319320321322323324325326327328329330331332333334335336337338339340341342343344345346347348349350351352353354355356357358359360361362363364365366367368369370371372373374375376377378379380381382383384385386387388389390391392393394395396397398399400401402403404405406407408409410411412413414415416417418419420421422423424425426427428429430431432433434435436437438439440441442443444445446447448449450451452453454455456457458459460461462463464465466467468469470471472473474475476477478479480481482483484485486487488489490491492493494495496497498499500501502503504505506507508509510511512513514515516517518519520521522523524525526527528529530531532533534535536537538539540541542543544545546547548549550551552553554555556557558559560561562563564565566567568569570571572573574575576577578579580581582583584585586587588589590591592593594595596597
1253254255256257258259260261262263264265266267268269270271272273274275276277278279280281282283284285286287288289290291292293294295296297298299300301302303304305306307308309310311312313314315316317318319320321322323324325326327328329330331332333334335336337338339340341342343344345346347348349350351352353354355356357358359360361362363364365366367368369370371372373374375376377378379380381382383384385386387388389390391392393394395396397398399400401402403404405406407408409410411412413414415416417418419420421422423424425426427428429430431432433434435436437438439440441442443444445446447448449450451452453454455456457458459460461462463464465466467468469470471472473474475476477478479480481482483484485486487488489490491492493494495496497498499500501502503504505506507508509510511512513514515516517518519520521522523524525526527528529530531532533534535536537538539540541542543544545546547548549550551552553554555556557558559560561562563564565566567568569570571572573574575576577578579580581582583584585586587588589590591592593594595596597
Увеличить/уменьшить масштаб
По ширине страницы
По высоте страницы
Постранично/Разворот
Поворот страницы
Навигация по документу
Закладки
Поиск в издании
Структура документа
Скопировать текст страницы
(работает в Chrome 42+,
Microsoft Internet Explorer и Mozilla FireFox
c установленным Adobe Flash Player)
Добавить в закладки
Текущие страницы выделены рамкой.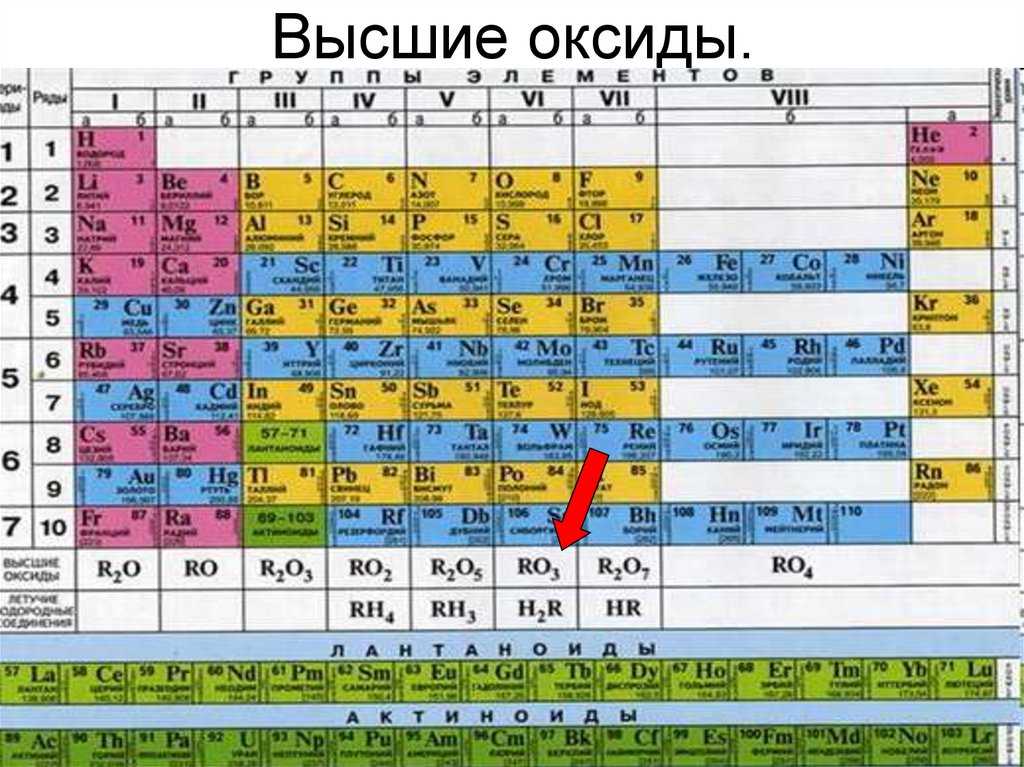
Содержание
ОбложкаОбложка
1Титульные листы
3Предисловие
5Глава 1. Химические элементы и их изотопы
5I. Историческое введение
5Развитие представлений о химических элементах
8Предсказание изотопии
11II. Изотопия
11Открытие изотопов
11Радиоактивные изотопы
15Стабильные изотопы
18Искусственная радиоактивность
20Новые химические элементы
21Объяснение изотопии
24Систематика изотопов
27III. Атомные веса изотопов
27Шкала атомных весов и их целочисленность
29Энергия ядерных превращений
33Глава 2. Изотопы в природе
33I. Постоянство изотопного состава
34II. Вариации в изотопном составе
34Зависимость от генезиса элементов
36Природное фракционирование изотопов
36[Введение]
36Углерод
38Кремний
38Сера
38Некоторые другие элементы
39Природные воды
41Воздух
42Органический водород и кислород
42Кислород пород и минералов
43Изотопный геологический термометр
44III. Определение геологического возраста изотопными методами
Определение геологического возраста изотопными методами
44[Введение]
44Свинцовый метод
46Гелиевый метод
46Стронциевый метод
47Аргоновый метод
47Углеродный метод
49Тритиевый метод
50IV. Распространенность изотопов
50Данные о распространенности элементов и изотопов
50Закономерности в распространенности
52Генезис элементов
54Глава 3. Разделение стабильных изотопов
54I. Теоретические основы
54Общие положения
56Основы теории фракционирования
56[Введение]
56Коэффициент разделения
58Простое выпаривание и формула Релея
59Перегонка с постоянным уровнем
59Фракционная колонка
60Предельное обогащение
61Теоретическая тарелка
62Колонка со сплошной насадкой
62Время достижения стационарного состояния
64Каскадные агрегаты
65II. Разделение фракционной перегонкой
65Коэффициент разделения
66Разделение изотопов
66Колонки для разделения
67Водород
68Кислород
68Неон
69III.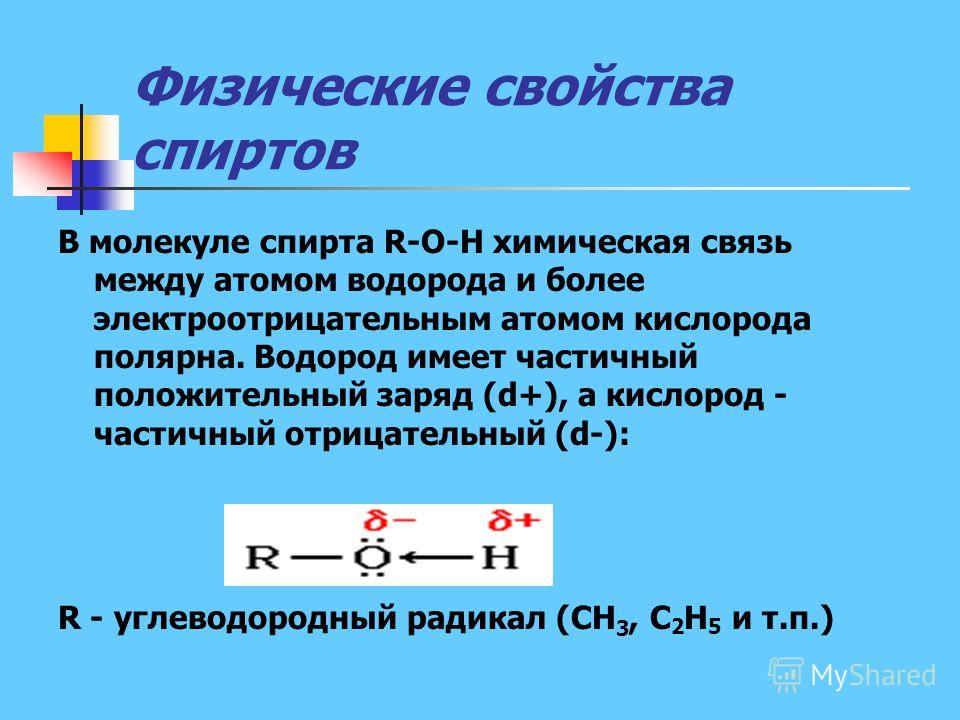 Разделение химическими методами
Разделение химическими методами
69Применение обменных реакций
70Разделение изотопов
70[Введение]
71Азот
73Сера
73Углерод
73Кислород
74Литий
74IV. Разделение диффузией
77V. Разделение термодиффузией
77Основы метода и коэффициент разделения
77Термодиффузия
80Термодиффузионная трубка
82Теория процесса
84Соединение трубок в батареи
85Разделение изотопов
88Термодиффузия жидких растворов
90Разделение посредством химического обмена в термодиффузионных приборах
91VI. Разделение центрифугированием
92VII. Разделение электролизом
92Коэффициент разделения изотопов водорода
93Получение тяжелой воды
96Разделение изотопов других элементов
97VIII. Разделение миграцией ионов
99IX. Фотохимическое разделение
99Х. Разделение адсорбцией
100XI. Разделение электромагнитными методами
102XII. Разделение изотопов гелия
105Глава 4. Анализ стабильных изотопов
105I.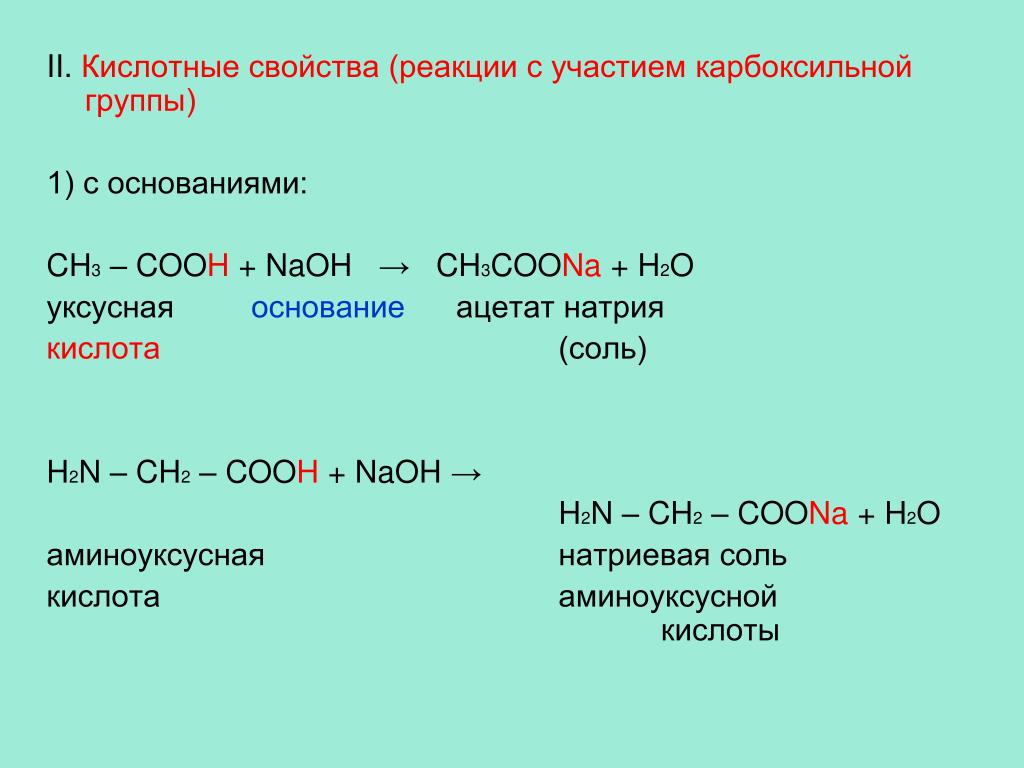 Масс-спектрометрический анализ
Масс-спектрометрический анализ
105Описание прибора
107Изотопный анализ
111Анализ водорода
116Анализ кислорода
119Анализ углерода и азота
121Анализ газовых смесей
123Анализ жидких и твердых тел
123Приборы для измерений атомных весов
125II. Изотопный анализ воды
125Изотопные разновидности воды
127Денсиметрический анализ
127[Введение]
129Пикнометрический метод
129Флотационный метод
132Микрофлотационный метод
133Капельные методы
134Очистка воды
134Рефрактометрический анализ
136Полный изотопный анализ
138III. Другие методы
138[Введение]
138Денсиметрические методы
139Анализ по теплопроводности
141Спектральный анализ
144Глава 5. Радиоактивные изотопы
144I. Радиоактивный распад
144Скорость распада
146Продукты распада
146Альфа-частицы
147Бета-частицы
149Гамма-лучи
152Нейтрино
154Нейтроны
156Мезоны
158II. Ядерные процессы
Ядерные процессы
158Общее течение ядерных реакций
159Эффективные сечения
165Реакции расщепления ядер
165Реакции нейтронов
167Реакции протонов
168Реакции дейтеронов
168Реакции α-частиц
169Ядерный фотоэффект
169Внутренняя конверсия
170К-захват
172Изомерные переходы
173Деление ядер
173Деление нейтронами
174Продукты деления
175Деление очень быстрыми частицами
177Спонтанное деление
177Капельная модель ядра
181III. Источники облучения
181Ускорители частиц
181[Введение]
181Электростатический генератор
183Линейные ускорители
184Циклотрон
185Фазотрон и синхрофазотрон
187Бетатрон и синхротрон
188Источники нейтронов
188[Введение]
189Радиоактивные источники
190Применение ускорителей частиц
191Ядерные реакторы
196IV. Получение, концентрирование и очистка препаратов
196Выбор изотопов
198Наиболее употребительные для индикации изотопы
199Облучение мишеней
199Выбор мишеней
200Время облучения и выход продуктов
201Концентрирование препаратов
201[Введение]
202Химические методы
203Реакции отдачи
207Разделение изомеров
207Соосаждение
211Другие методы
212V. Измерение радиоактивности
Измерение радиоактивности
212Единицы измерений
212[Введение]
213Удельная активность
214Методы измерений
214[Введение]
214Фотографический метод
214Камера Вильсона
215Метод сцинтилляций
215Химические дозиметры
216Ионизационные методы
217Ионизацнонные камеры
219Счетчик Гейгера — Мюллера
219Принцип действия
221Счетные трубки
222Регистрирующие приборы
223Измерение активности
225Поправки
226Точность измерений
228Сцинтилляционные счетчики
230Измерение нейтронов
230Радиография
234Глава 6. Физико-химические свойства изотопов
234I. Тяжелая вода и другие соединения дейтерия
234Некоторые физические свойства
234Свойства тяжелой воды
234[Введение]
235Плотность
237Критическая точка
237Термодинамические свойства
241Вязкость
241Другие свойства
242Тяжелая вода как растворитель
242Растворимость
244Электропроводность
245Сила кислот
246II. Изотопы гелия
Изотопы гелия
248III. Оптические свойства изотопов
248Изотопные смещения в спектрах
248[Введение]
248Атомные спектры
249Колебательные спектры
252Молекулярные спектры
253Применение к изучению строения
255Водородная связь
257Оптическая активность
258Рефракция
259IV. Влияние изотопии на скорость реакций
259Теоретические основы
264Определение изотопного эффекта из опытных данных
266Опытные данные
270Изотопный эффект в кислотно-основном катализе
270Протолитические реакции. Кислоты и основания
272Влияние изотопии
275Скорость переноса протона и дейтерона
276V. Самодиффузия
276Газы и жидкости
278Твердые тела
281Связь с электропроводностью
283Глава 7. Реакции изотопного обмена
283I. Общая характеристика
283[Введение]
284Коэффициент обмена
287II. Обмен изотопов водорода
287Зависимость от природы связей
291Обмен в связях C—H органических соединений
291Ионизационный механизм
294Влияние сопряжения
297Обмен по механизму электрофильного замещения
300Обмен в насыщенных углеводородах
302Обмен связанных радикалов
303Обмен в свободных радикалах
304Обмен на твердых катализаторах
306III. Обмен изотопов кислорода
Обмен изотопов кислорода
306Неорганические соединения
311Органические соединения
313Гетерогенный обмен
315IV. Обмен изотопов серы
315Неорганические соединения
317Органические соединения
320V. Обмен изотопов галоидов
320Неорганические соединения
322Органические соединения
323Механизм обмена
326VI. Обмен изотопов других элементов
326Углерод
327Азот
329Фосфор, мышьяк и сурьма
330VII. Обмен в комплексных соединениях
334VIII. Обмен в окислительно-восстановительных системах
337IX. Обмен между твердой фазой и раствором
338X. Термодинамика изотопного обмена
338Вычисление констант равновесия
338Основы расчета
340Реакции изотопного обмена
343Примеры
344Обмен в растворах
345Константа равновесия и коэффициент обмена
348XI. Кинетика изотопного обмена
348Гомогенный обмен
353Гетерогенный обмен
354Глава 8. Механизм химических реакций
354I. Гомогенные реакции
Гомогенные реакции
354Применение меченых атомов
355Этерификация и гидролиз эфиров
360Реакции окисления и восстановления
360Дисмутация альдегидов
363Восстановление альдегидов, солей диазония и других соединений
365Окисление карбоновых кислот, альдегидов и спиртов
366Окисление углеводородов
367Окисление и восстановление неорганических кислот
368Реакции перекисных соединений
371Термический распад органических соединений
372Реакции соединений азота
372Конденсация аминосоединений
375Реакция Меншуткина
376Аминирование хлорбензола
376Разложение фенилгидразина
377Реакции переаминирования
378Строение иона диазония и азидов
380Реакции соединений серы
380Полнсульфиды
380Политионаты
382Другие реакции
382II. Перегруппировки и таутомерия
382Реакции перегруппировок
382Водородная перегруппировка
384Перегруппировка Клайзена
387Циклизация диенонов
387Бензильная перегруппировка
388Бензидиновая перегруппировка
388Перегруппировка Бекмана
390Перегруппировка ароматических сульфокислот
391Реакция Рихтера
392Цис-транс изомерия
392Таутомерные превращения
392Кето-энольная таутомерия
394Таутомерия неорганических соединений
397Другие таутомерные превращения
397Отсутствие некоторых таутомерных превращений
399Водородная связь
401III. Адсорбция
Адсорбция
401[Введение]
401Измерение поверхностей
403Изучение адсорбции
403Изотерма адсорбции
405Электрохимическая адсорбция
406Неоднородность поверхности и дифференциальная адсорбция
409Адсорбция на коллоидах
410Электрохимическое изучение поверхностей
412IV. Катализ на поверхностях
412Орто-пара превращение
414Каталитический обмен изотопов водорода
416Каталитическое гидрирование
417Синтез аммиака
418Каталитические реакции изомеризации, дегидратации и др.
422Каталитическое окисление
425Глава 9. Применение изотопов в химическом анализе, технологии и сельском хозяйстве
425I. Анализ методом радиоактивных индикаторов
425[Введение]
425Методы количественного анализа
427Определение растворимости
428Проверка аналитических методик
429Физико-химические измерения
431Хроматографическое разделение
435II. Активационный анализ
435Основы метода
439Примеры
442Изотопный анализ
442Анализ просвечиванием
443III. Метод изотопного разбавления
Метод изотопного разбавления
447IV. Применение в промышленности
447Металлургия и металловедение
453Изучение трения и износа
454Высокополимерная, текстильная и бумажная технология
457Технология резины
460Другие области технологии
461V. Сельское хозяйство
467VI. Радиоактивные изотопы как источники излучений
471Глава 10. Применение изотопов в биологии
471I. Значение изотопов в биологических исследованиях
473II. Биохимические проблемы
473Фотосинтез растений
482Процессы брожения
483Превращения жирных кислот
485Цикл трикарбоновых кислот
488Синтез гликогена и гликогенолиз
490Превращения аминокислот
495Образование мочевины
496III. Физиологические применения
496Обмен веществ
496Жиры и аминокислоты
498Обмен фосфора
500Нуклеопротеины
503Скорость циркуляции и проницаемость тканей
505Система кровообращения
508Щитовидная железа
511Скелет
513Приложение I. Стабильные изотопы, их пропорция в природных элементах и точные атомные веса
Стабильные изотопы, их пропорция в природных элементах и точные атомные веса
521Приложение II. Наиболее употребительные искусственные радиоактивные изотопы
529Литература
571Именной указатель
578Предметный указатель
588Оглавление
596Концевая страница
597Исправления и опечатки
Обращаясь к сайту «История Росатома — Электронная библиотека»,
я соглашаюсь с условиями использования представленных там материалов.
Правила сайта (далее – Правила)
- Общие положения
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок
взаимодействия с Администрацией Сайта. - Любые материалы, размещенные на Сайте, являются объектами интеллектуальной собственности (объектами авторского права или смежных прав, а также прав на средства индивидуализации).
 Права Администрации
Права Администрации
Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности. - Использование материалов, размещенных на Сайте, допускается только с письменного согласия Администрации Сайта или иного правообладателя, прямо указанного на конкретном материале, размещенном на
Сайте, или в непосредственной близости от указанного материала. - Права на использование и разрешение использования материалов, размещенных на Сайте, принадлежащих иным правообладателям, нежели Администрация Сайта, допускается с разрешения таких правообладателей
или в соответствии с условиями, установленными такими правообладателями. Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала. - Настоящие Правила распространяют свое действие на следующих пользователей: информационные агентства, электронные и печатные средства массовой информации, любые физические и юридические лица, а также
индивидуальные предприниматели (далее — «Пользователи»).
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок
- Использование материалов. Виды использования
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные
способы использования, предусмотренные действующим законодательством Российской Федерации. - Использование материалов Сайта без получения разрешения от Администрации Сайта не допустимо.
- Внесение каких-либо изменений и/или дополнений в материалы Сайта запрещено.
- Использование материалов Сайта осуществляется на основании договоров с Администрацией Сайта, заключенных в письменной форме, или на основании письменного разрешения, выданного Администрацией Сайта.
- Запрещается любое использование (бездоговорное/без разрешения) фото-, графических, видео-, аудио- и иных материалов, размещенных на Сайте, принадлежащих Администрации Сайта и иным правообладателям
(третьим лицам).
- Стоимость использования каждого конкретного материала или выдача разрешения на его использование согласуется Пользователем и Администрацией Сайта в каждом конкретном случае.
- В случае необходимости использования материалов Сайта, права на которые принадлежат третьим лицам (иным правообладателям, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в
непосредственной близости от них), Пользователи обязаны обращаться к правообладателям таких материалов для получения разрешения на использование материалов.
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные
- Обязанности Пользователей при использовании материалов Сайта
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома»
(www. biblioatom.ru)
biblioatom.ru)
- в интернете или иных формах использования в электронном виде не на материальных носителях, Пользователи в каждом случае использования материалов обязаны разместить гиперссылку на Сайт —
электронная
библиотека «История Росатома» (www.biblioatom.ru), гиперссылка должна являться активной и прямой, при нажатии на которую Пользователь переходит на конкретную страницу Сайта, с которой заимствован
материал. - Ссылка на источник или гиперссылка, указанные в пп. 3.1.1 и 3.1.2. настоящих Правил, должны быть помещены Пользователем в начале используемого текстового материала, а также непосредственно
под используемым аудио-, видео-, фотоматериалом, графическим материалом Администрации Сайта.
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома»
- Размеры шрифта ссылки на источник или гиперссылки не должны быть меньше размера шрифта текста, в котором используются материалы Сайта, либо размера шрифта текста Пользователя, сопровождающего аудио-,
видео-, фотоматериалы и графические материалы Сайта, а также цвет ссылки должен быть идентичен цветам ссылок на Сайте и должен быть видимым Пользователю.
- Использование материалов с Сайта, полученных из вторичных источников (от иных правообладателей, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от
них), возможно только со ссылкой на эти источники и, в случае необходимости, установленной такими источниками (правообладателями), — с их разрешения. - Не допускается переработка оригинального материала (произведения), взятого с Сайта, в том числе сокращение материала, иная его переработка, в том числе приводящая к искажению его смысла.
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- Права на материалы третьих лиц, урегулирование претензий
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование
прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.
- В случае, если в обозначении авторства материалов в соответствии с п. 4.1. настоящих Правил содержится ошибка, или в случае использования материала с предполагаемым или реальным нарушением прав
третьих лиц, или в иных спорных случаях использования объектов интеллектуальной собственности, размещенных на Сайте, в том числе в случае, когда права третьего лица тем или иным образом нарушаются с
использованием Сайта, применяется следующая схема урегулирования претензий третьих лиц к Администрации Сайта:- в адрес Администрации Сайта по электронной почте на адрес [email protected] направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав; - Администрация Сайта обязуется рассмотреть надлежаще оформленную претензию в срок не менее 5 (пяти) рабочих дней с даты ее получения по электронной почте. Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии; - Администрация Сайта в любом случае предпринимает все возможные меры к скорейшему удовлетворению обоснованных претензий третьих лиц и стремиться к максимально скорому урегулированию всех
спорных
вопросов.
- в адрес Администрации Сайта по электронной почте на адрес [email protected] направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование
- Прочие условия
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения
вступают в силу с момента их опубликования на Сайте. - По всем вопросам использования материалов Сайта Пользователи могут обращаться к Администрации Сайта по следующим координатам: [email protected]
- Во всем, что не урегулировано настоящими Правилами в отношении вопросов использования материалов на Сайте, стороны руководствуются положениями Законодательства РФ.
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения
СогласенНе согласен
Дворцовая массивная доска GUNREBEN Schlossdiele Дуб natur/rustik Roh (без покрытия)
Ваш браузер устарел. Сайт может работать неправильно. Чтобы исправить проблему нажмите
здесь
Выбрать варианты
GUNREBEN Schlossdiele
21*180*2300-4000 мм
Объем :
1. 000 м2
000 м2
10600
руб/б
10600 руб/м2
Под заказ
GUNREBEN Schlossdiele
21*200*2300-4000 мм
Объем :
1.000 м2
10600
руб/б
10600 руб/м2
Под заказ
GUNREBEN Schlossdiele
21*220*2300-4000 мм
Объем :
1.000 м2
15800
руб/б
15800 руб/м2
Под заказ
GUNREBEN Schlossdiele
21*180*4100-6000 мм
Объем :
1.000 м2
17650
руб/б
17650 руб/м2
Под заказ
GUNREBEN Schlossdiele
21*200*4100-6000 мм
Объем :
1.000 м2
17650
руб/б
17650 руб/м2
Под заказ
GUNREBEN Schlossdiele
21*220*4100-6000 мм
Объем :
1.000 м2
17650
руб/б
17650 руб/м2
Под заказ
GUNREBEN Schlossdiele
21*180*6100-8000 мм
Объем :
1. 000 м2
000 м2
0
руб/б
Цена по запросу
Под заказ
GUNREBEN Schlossdiele
21*200*6100-8000 мм
Объем :
1.000 м2
0
руб/б
Цена по запросу
Под заказ
Параметры продукции
| Gunreben |
| Германия |
| 21*180*6100-8000 мм, 21*200*6100-8000 мм, 21*180*2300-4000 мм, 21*200*2300-4000 мм, 21*220*2300-4000 мм, 21*180*4100-6000 мм, 21*200*4100-6000 мм, 21*220*4100-6000 мм |
| Дуб |
| 22230400, 22230405, 22230408, 22230401, 22230406, 22230409, 22230390, 22230407 |
| Roh (без покрытия) |
| Массивная доска |
| Natur/Rustik, ringsum fase (с фаской по периметру) |
| Schlossdiele |
Описание
Дворцовая доска ОГРОМНОГО РАЗМЕРА из европейского дуба (ширины до 220 мм, длины до 8 метров).
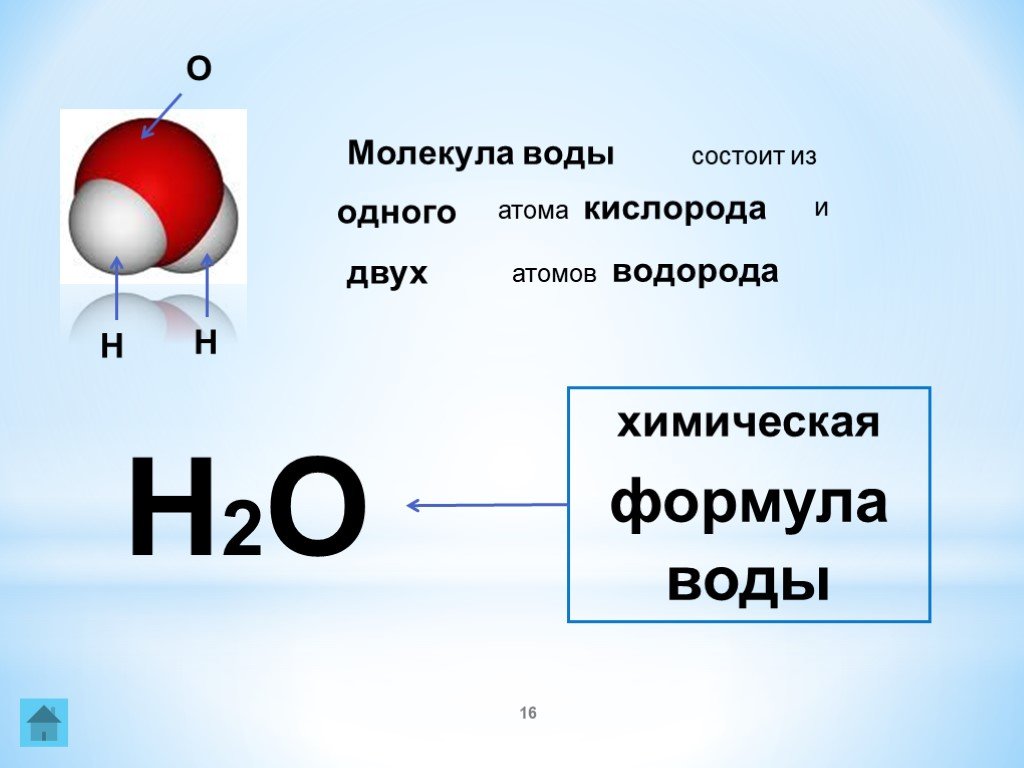
6.1: Спирты – Номенклатура и классификация
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 221808
Цели обучения
- Определить общую структуру спирта.
- Определите структурную особенность, которая классифицирует спирты как первичные, вторичные или третичные.
- Назовите спирты как общепринятыми названиями, так и названиями IUPAC
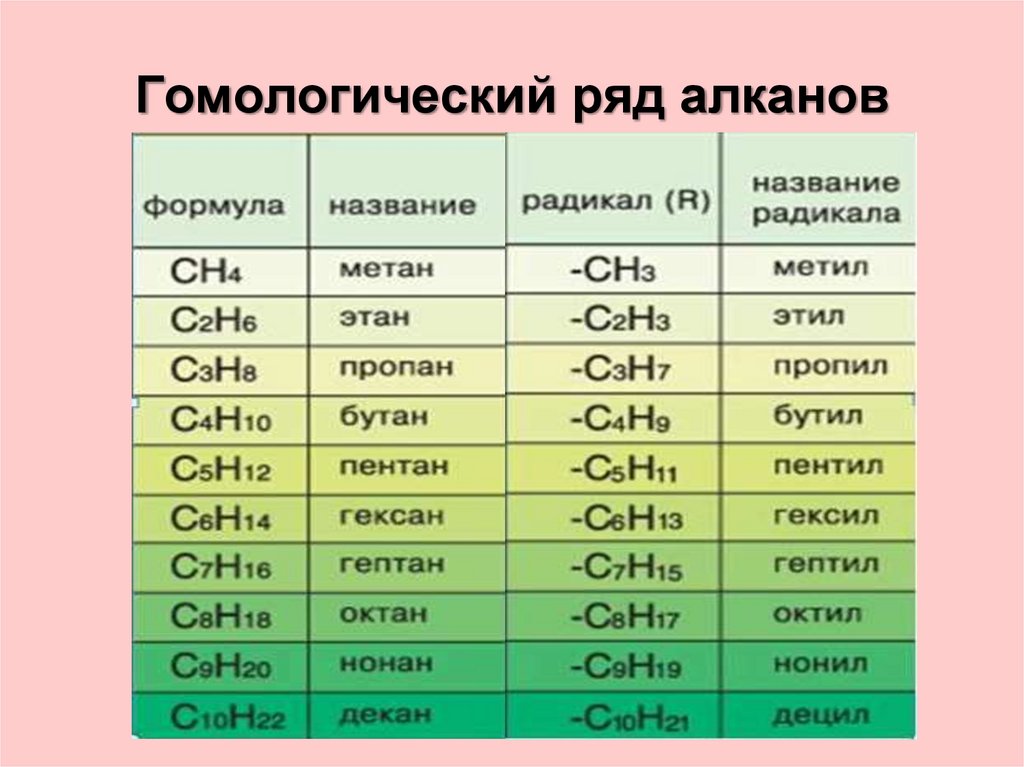
Спирт представляет собой органическое соединение с гидроксильной (ОН) функциональной группой на алифатическом атоме углерода. Поскольку ОН является функциональной группой всех спиртов, мы часто представляем спирты общей формулой ROH, где R представляет собой алкильную группу.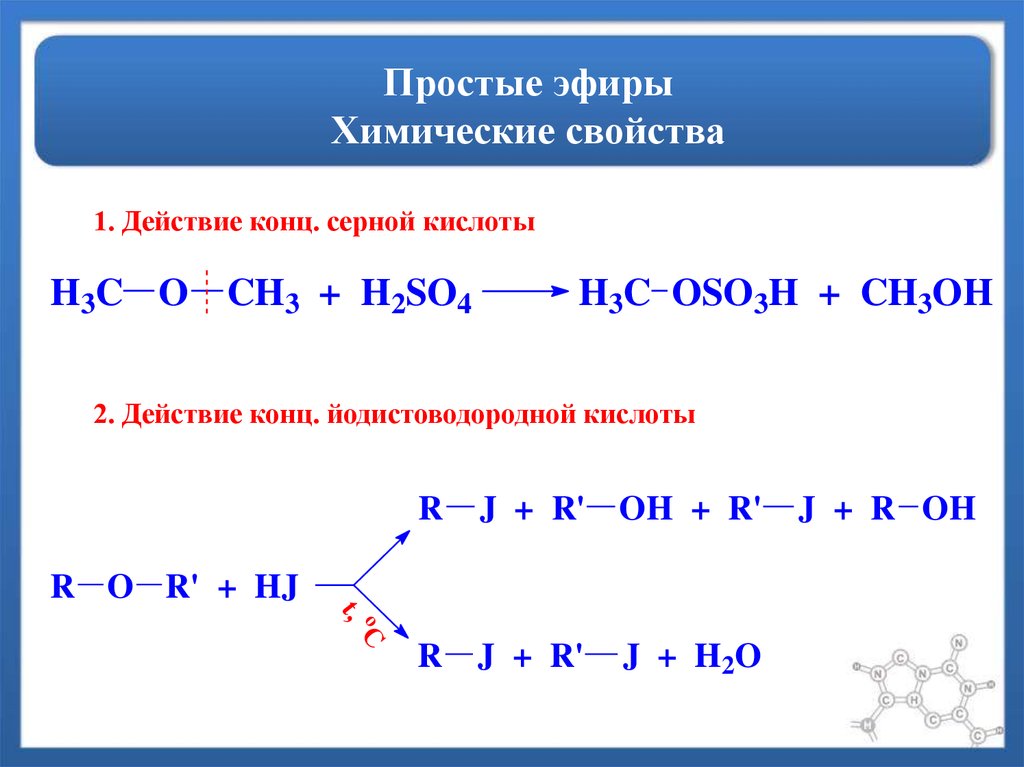 Спирты широко распространены в природе. Большинство людей знакомы с этиловым спиртом (этанолом), активным ингредиентом алкогольных напитков, но это соединение является лишь одним из семейства органических соединений, известных как спирты. В семейство также входят такие знакомые вещества, как холестерин и углеводы. Метанол (СН 3 ОН) и этанол (СН 3 СН 2 ОН) являются первыми двумя членами гомологического ряда спиртов.
Спирты широко распространены в природе. Большинство людей знакомы с этиловым спиртом (этанолом), активным ингредиентом алкогольных напитков, но это соединение является лишь одним из семейства органических соединений, известных как спирты. В семейство также входят такие знакомые вещества, как холестерин и углеводы. Метанол (СН 3 ОН) и этанол (СН 3 СН 2 ОН) являются первыми двумя членами гомологического ряда спиртов.
Номенклатура спиртов
Спирты с одним-четырьмя атомами углерода часто называют общепринятыми названиями, в которых за названием алкильной группы следует слово спирт :
Согласно Международному союзу чистых и прикладных Химия (IUPAC), спирты названы путем изменения окончания названия исходного алкана на — 9.0044 ол . Вот некоторые основные правила ИЮПАК для обозначения спиртов:
- В качестве исходного соединения берется самая длинная непрерывная цепь (НЦЦ) атомов углерода, содержащая группу ОН — алкан с таким же числом атомов углерода.
 Цепь нумеруется с конца, ближайшего к ОН-группе.
Цепь нумеруется с конца, ближайшего к ОН-группе. - Число, указывающее положение группы ОН, ставится перед названием исходного углеводорода, а окончание — и исходного алкана заменяется суффиксом — ол . (В циклических спиртах атом углерода, несущий группу ОН, обозначается C1, но цифра 1 в названии не используется.) Заместители названы и пронумерованы, как в алканах.
- Если в одной и той же молекуле присутствует более одной группы ОН (полигидроксиспирты), используются такие суффиксы, как — диол и — триол . В этих случаях сохраняется окончание — и исходного алкана.
На рисунке \(\PageIndex{1}\) показаны некоторые примеры применения этих правил.
Рисунок \(\PageIndex{1}\): Правила ИЮПАК для спиртов. Названия и структуры некоторых спиртов демонстрируют использование правил IUPAC.
Пример \(\PageIndex{1}\)
Дайте имя IUPAC для каждого соединения.
- HOCH 2 CH 2 CH 2 CH 2 CH 2 OH
Раствор
- Десять атомов углерода в LCC делают соединение производным декана (правило 1), а ОН на третьем атоме углерода делает его 3-деканолом (правило 2).

Атомы углерода нумеруются с конца, ближайшего к группе ОН. Это фиксирует две метильные группы (CH 3 ) в шестом и восьмом положениях. Название 6,8-диметил-3-деканол (не 3,5-диметил-8-деканол).
- Пять атомов углерода в LCC делают соединение производным пентана. Две группы ОН у первого и пятого атомов углерода делают соединение диолом и дают название 1,5-пентандиол (правило 3).
Упражнение \(\PageIndex{1}\)
Дайте название IUPAC для каждого соединения.
Пример \(\PageIndex{2}\)
Нарисуйте структуру каждого соединения.
- 2-гексанол
- 3-метил-2-пентанол
Раствор
- Окончание — ол указывает на спирт (функциональная группа ОН), а hex — основа говорит нам о том, что в LCC шесть атомов углерода. Начнем с рисования цепочки из шести атомов углерода: –C–C–C–C–C–C–.

Цифра 2 указывает на то, что группа ОН присоединена ко второму атому углерода.
Наконец, мы добавляем столько атомов водорода, чтобы у каждого атома углерода было четыре связи.
- Окончание — ол указывает на функциональную группу ОН, а пент — основа говорит нам о том, что в LCC пять атомов углерода. Начнем с рисования цепочки из пяти атомов углерода: –C–C–C–C–C–
Цифры указывают на наличие метила (CH 3 ) группа у третьего атома углерода и группа ОН у второго атома углерода.
Упражнение \(\PageIndex{2}\)
Нарисуйте структуру каждого соединения.
3-гептанол
2-метил-3-гексанол
Классификация спиртов
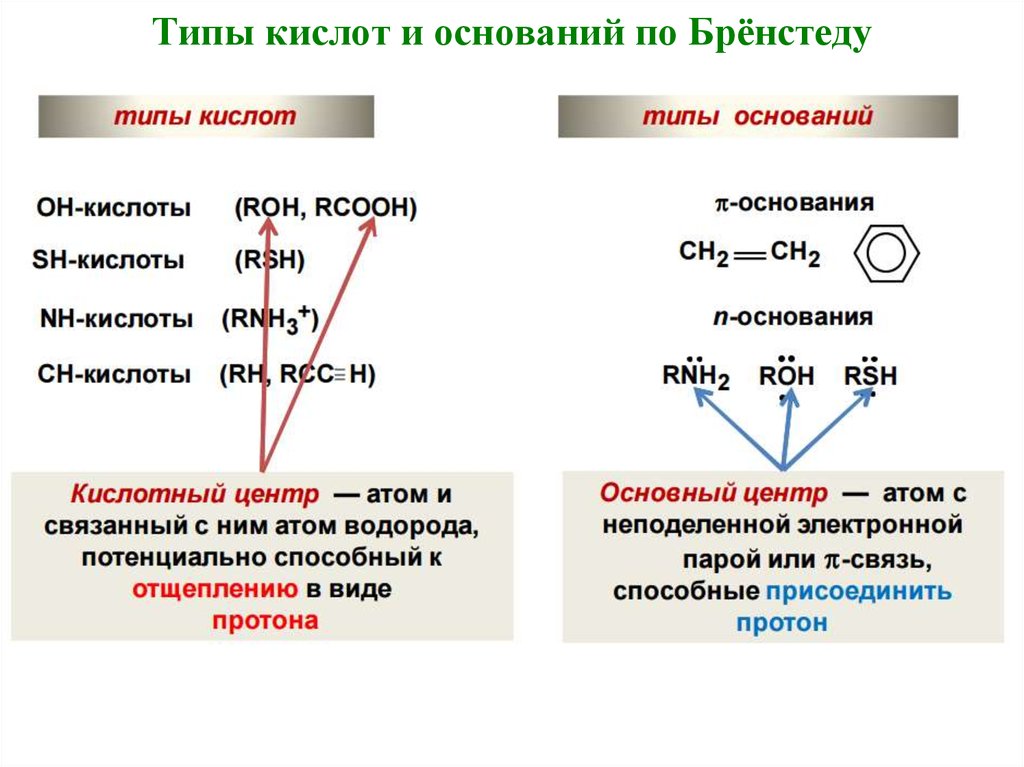
Некоторые свойства спиртов зависят от количества атомов углерода, присоединенных к конкретному атому углерода, присоединенному к группе ОН. На этом основании спирты можно разделить на три класса.
На этом основании спирты можно разделить на три класса.
- Первичный (1°) спирт — это спирт, в котором атом углерода (обозначен красным) с группой ОН присоединен к одному другому атому углерода (обозначен синим). Его общая формула: RCH 2 OH.
- Вторичный (2°) спирт — это спирт, в котором атом углерода (красный) с группой ОН присоединен к двум другим атомам углерода (синий). Его общая формула: R 2 CHOH.
- Третичный (3°) спирт – это спирт, в котором атом углерода (обозначен красным) с группой ОН присоединен к три других атомов углерода (синий). Его общая формула: R 3 COH.
Таблица \(\PageIndex{1}\) называет и классифицирует некоторые из более простых спиртов. Некоторые из общепринятых названий отражают классификацию соединений как вторичные ( сек -) или третичные ( трет -). Эти обозначения не используются в номенклатурной системе IUPAC для спиртов.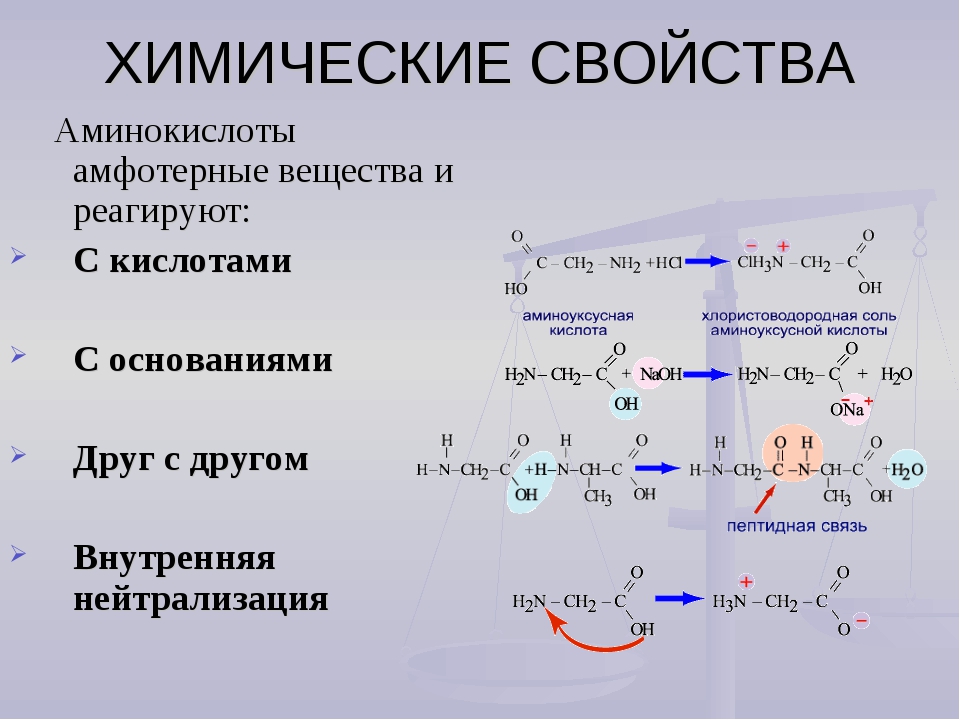 Обратите внимание, что в таблице есть четыре бутиловых спирта, соответствующих четырем бутильным группам: бутильная группа (CH 3 CH 2 CH 2 CH 2 ) обсуждались выше, и три других:
Обратите внимание, что в таблице есть четыре бутиловых спирта, соответствующих четырем бутильным группам: бутильная группа (CH 3 CH 2 CH 2 CH 2 ) обсуждались выше, и три других:
| Краткая структурная формула | Класс спирта | Общее имя | Название ИЮПАК |
|---|---|---|---|
| CH 3 OH | — | спирт метиловый | метанол |
| CH 3 CH 2 ОН | первичный | спирт этиловый | этанол |
| СН 3 СН 2 СН 2 ОН | первичный | пропиловый спирт | 1-пропанол |
| (CH 3 ) 2 СНОН | вторичный | изопропиловый спирт | 2-пропанол |
| CH 3 CH 2 CH 2 CH 2 OH | первичный | бутиловый спирт | 1-бутанол |
| СН 3 СН 2 СНОНСН 3 | вторичный | сек -Спирт бутиловый | 2-бутанол |
| (СН 3 ) 2 СНСН 2 ОН | первичный | спирт изобутиловый | 2-метил-1-пропанол |
| (CH 3 ) 3 COH | высшее | трет-бутиловый спирт | 2-метил-2-пропанол |
| вторичный | спирт циклогексиловый | циклогексанол |
Резюме
В системе IUPAC спирты получают путем изменения окончания названия исходного алкана на — ol . Спирты классифицируются по количеству атомов углерода, присоединенных к атому углерода, присоединенному к группе ОН.
Спирты классифицируются по количеству атомов углерода, присоединенных к атому углерода, присоединенному к группе ОН.
Упражнения по обзору концепции
Является ли изобутиловый спирт первичным, вторичным или третичным? Объяснять.
Что такое LCC в 2-этил-1-гексаноле? Что принимают за LCC при наименовании соединения? Объяснять.
Ответы
первичный; атом углерода, несущий группу ОН, присоединен только к одному другому атому углерода
7 атомов углерода; цепь из 6 атомов включает атом углерода, несущий ОН-группу
Упражнения
Назовите каждый спирт и классифицируйте его как первичный, вторичный или третичный.
- CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 OH
Назовите каждый спирт и классифицируйте его как первичный, вторичный или третичный.

Нарисуйте структуру каждого спирта.
- 3-гексанол
- 3,3-диметил-2-бутанол
- циклобутанол
Нарисуйте структуру каждого спирта.
- циклопентанол
- 4-метил-2-гексанол
- 4,5-диметил-3-гептанол
Ответы
- 1-гексанол; первичный
- 3-гексанол; вторичный
- 3,3-дибром-2-метил-2-бутанол; высшее
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Показать страницу TOC
- № на стр.

- Теги
- источник[1]-хим-16042
- источник[2]-chem-16042
Синтез эфира Вильямсона – Мастер органической химии
Все о синтезе эфира Вильямсона
В предыдущем посте мы обсуждали кислотно-основные свойства спиртов. Два поста назад мы говорили, что кислотно-основные реакции часто используют для «постановки» реакций замещения и элиминирования спиртов. В этом посте мы поговорим о том, что, вероятно, является лучшим примером этого последнего пункта — Williamson Ether Synthesis .
Спойлер: это просто S N 2 реакция между RO(-) и алкилгалогенидом, но есть много мелких складок. Читай дальше!
Содержание
- Что такое синтез эфира Вильямсона?
- Почему мы используем R–O(–), а не R–OH в качестве нуклеофила?
- Какие алкилгалогениды хорошо работают в синтезе эфира Вильямсона?
- Начиная со спирта: хороший и плохой выбор основания
- Как выбрать растворитель для синтеза эфира по Вильямсону?
- Резюме: Синтез эфира Вильямсона
- (Дополнительно) Ссылки и дополнительная литература
1.
 Что такое синтез эфира Вильямсона?
Что такое синтез эфира Вильямсона?
Williamson Ether Synthesis — старая реакция, восходящая к 1851 году, но до сих пор не превзойденная. Просто нет более простого способа сделать эфир.
Это тип реакции, которую мы уже видели много раз раньше — реакция S N 2 между депротонированным спиртом [«алкоксидом»] и алкилгалогенидом, который образует эфир. ( См. статью: The S N 2 Механизм )
Обратите внимание, что здесь мы образуем и , разрывая связь на углероде — хрестоматийный признак реакции замещения .
Это стандартная реакция. Оно работает. Но просто взглянув на Williamson, который «работает», мы получим только половину картины. В оставшейся части этого поста мы рассмотрим, как Уильямсон может пойти не так, и ответим на следующие вопросы:
- Почему RO-, а не ROH в качестве нуклеофил ?
- Какие алкилгалогениды работают хорошо, а какие нет?
- Если мы начнем со спирта (ROH) и добавим основание, чтобы получить RO- , как мы выберем хорошее основание для использования?
- Как выбрать растворитель ?
Давайте углубимся.
2. Почему мы используем RO – , а не ROH в качестве нуклеофила?
Первое, что вы можете заметить в Williamson, это тот факт, что мы используем алкоксид (RO – ) в дополнение к спирту (ROH) в реакции. Вы спросите, а зачем заморачиваться?
Не будет ли ROH реагировать с алкилгалогенидом так же, как RO – , и по-прежнему давать нам эфир?
Ответ возвращается к тому, о чем мы говорили два поста назад: сопряженное основание всегда является лучшим нуклеофилом. Реакция RO – с алкилгалогенидом всегда будет намного быстрее, чем реакция ROH, из-за более высокой электронной плотности на нуклеофиле (кислороде). Вот почему мы используем RO – . ( См. публикацию: Что делает хорошего нуклеофила? )
Наиболее распространенный способ представить алкоксид, добавленный в присутствии спирта.
Также можно начать со спирта, добавить основание , чтобы получить RO – , а затем добавить алкилгалогенид [, обратите внимание на затененный раздел ].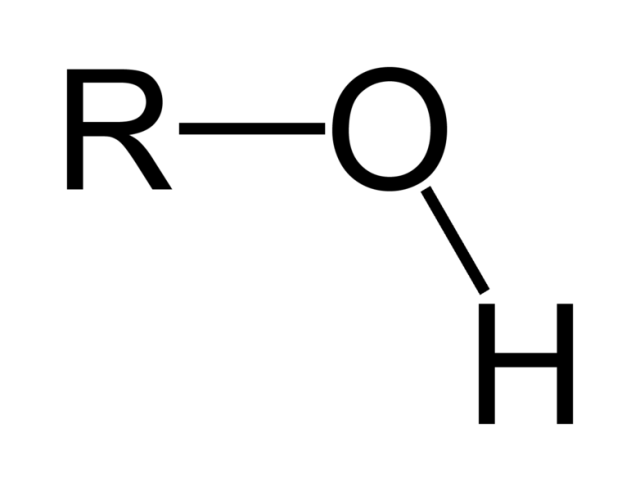 Мы поговорим об этом ниже.
Мы поговорим об этом ниже.
3. Какие алкилгалогениды хорошо работают в синтезе эфира Вильямсона? (а какие нет)
Здесь мы возвращаемся к концепциям из середины организации 1, которые всплывают в этой главе, посвященной спиртам.
Синтез эфира Вильямсона представляет собой реакцию S N 2 . Помните, что поскольку реакция S N 2 протекает через одну стадию, когда нуклеофил выполняет «атаку обратной стороны» на алкилгалогенид, «большим барьером» для реакции S N 2 является стерических затруднений.
Скорость реакции S N 2 была наибольшей для метилгалогенидов, затем первичных, затем вторичных, затем третичных (которых по сути вообще не бывает). Тот же образец существует для реакции эфира Вильямсона.
Метил и первичные алкилгалогениды являются отличными субстратами для Вильямсона.
[ одно исключение: очень затрудненный анион трет-бутоксида (t-BuO-) медленнее вступает в реакцию S N 2 , чем его другие алкоксидные аналоги. Этот алкоксид, также являющийся сильным основанием, вместо этого может начать давать побочные продукты элиминирования (Е2) при использовании первичных алкилгалогенидов, особенно при нагревании ].
Этот алкоксид, также являющийся сильным основанием, вместо этого может начать давать побочные продукты элиминирования (Е2) при использовании первичных алкилгалогенидов, особенно при нагревании ].
Поскольку алкоксиды являются сильными основаниями (напомним, что pK a спиртов находится в диапазоне 16-18), конкуренция с путями элиминации [E2] становится проблемой, когда алкилгалогенид становится более стерически затрудненным.
По этой причине попытка провести анализ Вильямсона на вторичном алкилгалогениде несколько более проблематична, чем на первичном алкилгалогениде .
Один из способов добиться преимущества S N 2 перед E2 заключается в использовании полярного апротонного растворителя (такого как ацетонитрил или ДМСО), который увеличивает нуклеофильность алкоксида. Однако, если применяется тепло, E2, скорее всего, будет доминировать.
Одним из субстратов, который полностью не соответствует с помощью Williamson, являются третичные алкилгалогениды. Это не должно вызывать удивления, поскольку атака с обратной стороны третичного алкилгалогенида сталкивается с огромными стерическими затруднениями. Вместо замещения происходят реакции элиминации по механизму Е2 ( См. пост: Механизм Е2 )
Это не должно вызывать удивления, поскольку атака с обратной стороны третичного алкилгалогенида сталкивается с огромными стерическими затруднениями. Вместо замещения происходят реакции элиминации по механизму Е2 ( См. пост: Механизм Е2 )
4. Начиная со спирта и добавляя основание – что работает?
Как упоминалось выше, наиболее распространенный способ представления шкалы Вильямсона состоит в том, чтобы показать, как алкоксидное основание добавляется к алкилгалогениду в присутствии сопряженной с ним кислоты в качестве растворителя.
Однако также можно начать со спирта, добавить основание (с образованием алкоксида), а затем добавить алкилгалогенид.
Вопрос в том, какую базу мы должны использовать?
Прежде всего, само собой разумеется, что основание должно быть достаточно сильным, чтобы действительно депротонировать спирт . Использование чего-то вроде Cl- или RCO 2 – (ацетат) не поможет. В идеале нам нужно что-то не менее сильное, чем алкоксид, или даже сильнее.
В идеале нам нужно что-то не менее сильное, чем алкоксид, или даже сильнее.
Во-вторых, нам нужно беспокоиться о побочных реакциях. Было бы полезно подумать о том, как эти реакции протекают. Обычно мы начинаем с колбы со спиртовым растворителем, добавляем основание, а затем добавляем наш алкилгалогенид. Затем, когда реакция завершится, мы выделяем продукт. Это означает, что после депротонирования основания его сопряженная кислота все еще плавает в растворе и, следовательно, может вступить в реакцию с нашим алкилгалогенидом (испортить ситуацию).
Вот пример плохой выбор основания:
NaNH 2 определенно является достаточно сильным основанием для депротонирования спирта. Однако после того, как это сделано, мы имеем NH 3 в растворе, и это достаточно хороший нуклеофил, чтобы реагировать с алкилгалогенидом, давая нам побочные продукты амина в нашей реакции . Не идеально!
Как мы можем сделать это правильно? Можно сделать алкоксид непосредственно из спирта, просто добавив металлический натрий или калий, который высвобождает водород. Водород является совершенно безвредным побочным продуктом в отношении алкилгалогенида — он не будет действовать как конкурирующий нуклеофил, а будучи газом, просто пузырится из раствора. После образования алкоксида мы можем добавить наш алкилгалогенид.
Водород является совершенно безвредным побочным продуктом в отношении алкилгалогенида — он не будет действовать как конкурирующий нуклеофил, а будучи газом, просто пузырится из раствора. После образования алкоксида мы можем добавить наш алкилгалогенид.
Другой (но более распространенный) способ сделать это — добавить гидрид натрия или калия (например, NaH или KH) . Это имеет тот же эффект, что и добавление металлического натрия или калия — образует алкоксид, а также H 2 — и имеет дополнительный бонус, заключающийся в том, что он не сильно восстанавливается, что может вызвать беспокойство, если мы имеем дело со сложным исходным материалом, который легко восстанавливается. .
5. Как выбрать растворитель для синтеза эфира Вильямсона?
Как упоминалось выше, наш обычный растворитель – это сопряженная кислота алкоксида . [Есть исключения — мы можем попробовать использовать полярный апротонный растворитель, если нас беспокоит конкуренция с E2].
Вопрос «почему» ? Вы поняли это?
Представьте, что мы решили добавить этоксид натрия в пропанол, а затем добавить наш алкилгалогенид. Что может случиться?
Это установит равновесие! Наш «этоксид натрия» не будет оставаться таким долго — он может депротонировать пропанол, чтобы получить пропоксид натрия вместе с этанолом. Теоретически мы можем иметь смесь этоксида натрия и пропоксида натрия в растворе, что может привести к смеси эфирных продуктов. Опять же не идеал.
Зачем доставлять себе эту головную боль? Это бессмысленно. По этой причине мы значительно упростим ситуацию, если будем использовать только спиртовой растворитель, который представляет собой сопряженную кислоту алкоксида.
6. Резюме: Синтез эфира Вильямсона
Это все, что можно сказать о Вильямсоне на сегодня. Однако в следующем посте мы подумаем об этой реакции назад . Начав с данного эфира, как мы можем спланировать его синтез с помощью реакции Вильямсона?
Следующий пост – Синтез эфира Вильямсона: планирование
Примечания
(Дополнительно) Ссылки и дополнительная литература:
- XLV.


 Права Администрации
Права Администрации

 biblioatom.ru)
biblioatom.ru)


 В претензии также указывается адрес
В претензии также указывается адрес

 Цепь нумеруется с конца, ближайшего к ОН-группе.
Цепь нумеруется с конца, ближайшего к ОН-группе.